
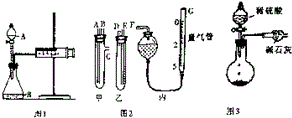
 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.| 样品号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸溶液的体积/mL | 30 | 30 | 30 | 30 |
| 样品质量/g | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积/mL | 672 | 840 | 896 | 672 |
分析 (1)欲检查装置气密性,可根据该反应容器的特点,采用拉动注射器活塞的方法完成;
(2)由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸,连接导管时,应用A连接D,B连接E,C连接F;
(3)根据碱石灰的成分可知,碱石灰既可吸收二氧化碳也可吸收水,同时生成的二氧化碳反应后在装置内会有残留,以及干燥管与空气接触等进行分析即可;
(4)根据碳元素守恒计算,分析图表数据,ⅠⅣ对比可知,Ⅰ组样品全部反应,Ⅳ组盐酸全部反应生成二氧化碳气体为672ml物质的量=$\frac{0.672L}{22.4L/mol}$=0.03mol,样品是均一的,取3.28g天然碱样品于300℃加热至分解完全(300℃Na2CO3不分解),产生CO2224mL(标准状况)和一定量的水,说明含有碳酸钠和碳酸氢钠,其中碳酸氢钠分解生成二氧化碳物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,中NaHCO3物质的量为0.02mol,结合实验Ⅰ计算,若3.28g样品全部和盐酸反应,生成二氧化碳物质的量为x,则3.32g:0.03mol=3.28g:x,计算x=0.0296mol,结合碳元素守恒,3.28g样品中碳酸钠物质的量为=0.0296mol-0.02mol≈0.01mol,样品中含水的质量=3.28g-0.01mol×106g/mol-0.02mol×84g/mol=0.54g,计算物质的量得到样品组成比得到化学式.
解答 解:(1)欲检查装置气密性,可根据该反应容器的特点,采用拉动注射器活塞的方法完成,具体操作为关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气,
故答案为:关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气;
(2)由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸,G为量气装置,根据构造,可用碱式滴定管代替,连接导管时,应用A连接D,B连接E,C连接F,
故答案为:甲;乙;碱式滴定管;D;E;F;
(3)因生产的CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,会导致质量偏大,使测定结果可能偏小的主要原因装置中的CO2没有全部被碱石灰吸收,应通入氮气可将气体排出,
故答案为:CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中;装置中的CO2没有全部被碱石灰吸收;
(4)根据碳元素守恒计算,分析图表数据,ⅠⅣ对比可知,Ⅰ组样品全部反应,Ⅳ组盐酸全部反应生成二氧化碳气体为672ml物质的量=$\frac{0.672L}{22.4L/mol}$=0.03mol,样品是均一的,取3.28g天然碱样品于300℃加热至分解完全(300℃Na2CO3不分解),产生CO2224mL(标准状况)和一定量的水,说明含有碳酸钠和碳酸氢钠,其中碳酸氢钠分解生成二氧化碳物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,3.28g样品中,n(NaHCO3)=2n(CO2)=2×$\frac{0.224L}{22.4L/mol}$=0.02mol,NaHCO3物质的量为0.02mol,结合实验Ⅰ,若3.28g样品全部和盐酸反应,生成二氧化碳物质的量为x,则3.32g:0.03mol=3.28g:x,计算x=0.0296mol,结合碳元素守恒,3.28g样品中碳酸钠物质的量为=0.0296mol-0.02mol≈0.01mol,样品中含水的质量=3.28g-0.01mol×106g/mol-0.02mol×84g/mol=0.54g,物质的量=$\frac{0.54g}{18g/mol}$=0.03mol,则n(Na2CO3)n(NaHCO3):n(H2O)=0.01:0.02:0.03=1:2:3,组成的化学式为Na2CO3•2NaHO3•3H2O,
故答案为:Na2CO3•2NaHO3•3H2O.
点评 本题考查了物质组成和含量的实验测定方法分析判断,实验装置的理解应用,主要是数据处理的方法应用技术,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4与C2H4 | B. | C2H2与C2H4 | C. | C2H2与C2H6 | D. | CH4与C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=2Q2=92.4 | B. | 92.4=Q1<2Q2 | C. | 92.4>Ql>2Q2 | D. | Q1=2Q2<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔是乙炔发生聚合反应形成的高聚物 | |
| B. | 聚乙炔的化学式为 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 聚乙炔不可能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 | |
| D. | 纯净的强电解质在液态时,有的导电,有的不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com