
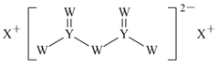
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
A.熔点:Y单质高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.W的简单氢化物稳定性比Y的简单氢化物稳定性低
D.W分别与X、Y、Z形成的二元化合物均只有两种
【答案】A
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,X为Na元素;由W、X、Y三种元素形成的化合物M的结构分析,Y形成四个共价键,说明Y为Si元素;Y的原子序数是Z的最外层电子数的2倍,则Z为Cl元素;W的核外电子数与X、Z的最外层电子数之和相等,W为O元素;依此答题。
A. 单质Si为原子晶体,单质Na是金属晶体,单质Si的熔点高于单质Na,A正确;
B. W为O元素、Y为Si元素、Z为Cl元素,同周期,从左到右,非金属性增强;同主族,从上到下,非金属性减弱,O、Si、Cl三种元素非金属性强弱为:O>Cl>Si,B错误;
C. W为O元素、Y为Si元素,O的非金属性比Si强,所以O的氢化物的稳定性比Si的氢化物强,C错误;
D. W为O元素,与Si元素只能组成SiO2,D错误;
答案为A。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
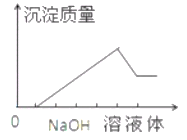
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
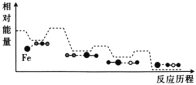
下列叙述错误的是( )
A.Fe*是反应的催化剂
B.两步反应的ΔH均小于0
C.第一步反应比第二步反应快
D.总反应为CO+N2O=N2+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A.达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时υ正>υ逆
B.两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C.反应过程中,容器Ⅰ与容器Ⅱ中的总压强之比为3∶1
D.温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、 1 mol O2 | 4 mol SO3 | 2 mol SO2、 1 mol O2 |
平衡υ正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.υ1<υ3,α1(SO2)>α3(SO2)
B.K1>K3,p2>2p3
C.c2>2c3,α2(SO3)+α3(SO2)>1
D.υ1<υ2,c2<2c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡是最重要的化学反应原理之一。
(1)现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g)![]() C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
①在题干条件下,说明该反应已经达到平衡状态的有__(填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是___(填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=__。
(2)在一容积可变的密闭容器中充有10molCO和20molH2,发生CO(g)+2H2(g)![]() CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为___。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为___L。
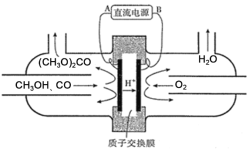
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为___(填“A”或“B”),写出阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
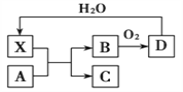
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧B.①③④⑤C.①②③④⑤⑦D.①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的乙烯,完全燃烧时放出的热量为Q,完全吸收燃烧后所生成的CO2气体需要200mL 2mol/L的NaOH溶液,则28g乙烯完全燃烧放出的热量不可能是
A. 5QB. 5Q~10QC. 10QD. 大于10Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com