
��25��ʱ��2L���ܱ�������A��B��C��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
| �� �� | A | B | C |
| ��ʼŨ��/mol��L-1 | 1.0 | 2.0 | 0 |
| 2minʱ��ƽ��Ũ��/mol��L-1 | 0.4 | 0.2 | 1.2 |


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ�� ��� |
�¶ȡ� | ��ʼn��CCl4�� ��mol�� |
��ʼn��H2�� ��mol�� |
ƽ��ʱn��CHCl3�� ��mol�� |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Fe2O3 | CO | Fe | CO2 | |
| �� | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| �� | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
| ʵ����� | Ԥ�������� |
| ����1��ȡ������Ʒ���ձ��м�����ϡ�����ܽ� | \ |
| ����2�� ȡ��������1������Һ���Թ��еμӼ���KSCN��Һ ȡ��������1������Һ���Թ��еμӼ���KSCN��Һ |
����Һ�����֤����Ʒ�к������� ���������֤����Ʒ�в��������� ����Һ�����֤����Ʒ�к������� ���������֤����Ʒ�в��������� |
| ����3�� ��ȡ��������1������Һ���Թ��еμӼ���KMnO4��Һ ��ȡ��������1������Һ���Թ��еμӼ���KMnO4��Һ |
��KMnO4��Һ��ɫ��ȥ��֤����Ʒ�к��������� ��KMnO4��Һ����ɫ��֤����Ʒ�в����������� ��KMnO4��Һ��ɫ��ȥ��֤����Ʒ�к��������� ��KMnO4��Һ����ɫ��֤����Ʒ�в����������� |
| ����4�� �� �� |
�� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n��HI��/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
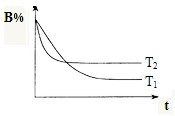 ��t��ʱ�����ݻ�Ϊ2L���ܱ��������м���1mol A���塢3mol B���弰��������������������з�Ӧ��A��g��+3B��g��?2C��g������H��0��10min������ʵ�Ũ�Ȳ��ٱ仯���������C���������Ϊ25%������գ�
��t��ʱ�����ݻ�Ϊ2L���ܱ��������м���1mol A���塢3mol B���弰��������������������з�Ӧ��A��g��+3B��g��?2C��g������H��0��10min������ʵ�Ũ�Ȳ��ٱ仯���������C���������Ϊ25%������գ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com