
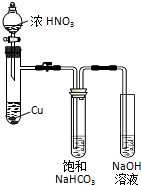
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:分析 (1)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,根据电荷守恒和元素守恒书写离子反应方程式;
(2)①二氧化氮与水反应生成硝酸;
②NO2与NaHCO3溶液反应生成NaNO2,此时氮的化合价降低,根据氧化还原反应的原理可知,还应有硝酸根生成;
(3)X中既有NaNO2又有NaNO3,在酸性条件下都能氧化碘离子;
(4)用所配的酸性KMnO4溶液进行滴定NaNO2溶液,原来NaNO2溶液无色,滴点终点时溶液由无色变为浅红色,根据反应5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,利用高锰酸钾的物质的量可计算出X中所含有的NaNO2的物质的量,进而确定NaNO2的浓度;
解答 解:(1)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子反应方程式为Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O;
(2)①二氧化氮与水反应也能生成硝酸根,所以检验X中存在NO3-不能说明是NO2和NaHCO3溶液反应生成了硝酸根,
故答案为:二氧化氮与水反应也能生成硝酸根;
②NO2与NaHCO3溶液反应生成NaNO2,此时氮的化合价降低,根据氧化还原反应的原理可知,还应有硝酸根生成,所以NO2与NaHCO3溶液反应的化学方程式为2NO2+2NaHCO3═NaNO2+NaNO3+2CO2+H2O,
故答案为:2NO2+2NaHCO3═NaNO2+NaNO3+2CO2+H2O;
(3)X中既有NaNO2又有NaNO3,NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质,所以不能用KI淀粉溶液检验X中存在NaNO2,
故答案为:不能;NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质;
(4)用所配的酸性KMnO4溶液进行滴定NaNO2溶液,原来NaNO2溶液无色,滴点终点时溶液由无色变为浅红色,所以滴点终点的现象是滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色,高锰酸钾的物质的量为$\frac{6.32}{158}×\frac{25}{250}$mol=0.004mol,根据反应5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,可知20.00mL X溶液中所含有的NaNO2的物质的量为0.004mol×$\frac{5}{2}$=0.01mol,所以NaNO2的浓度为$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色;0.5.
点评 本题考查较为综合,以物质的制备实验为载体,综合考查实验的设计、物质的检验、氧化还原滴定等知识,注意根据物质的性质设计实验方案,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 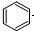 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$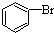 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56克亚铁离子得到2NA个电子被还原成单质 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物质的量为NA | |
| C. | 在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA | |
| D. | 0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
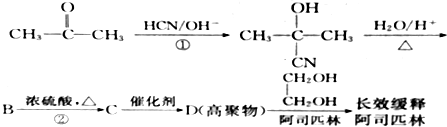
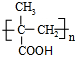
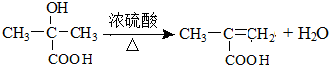
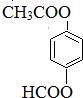 (只写一种)
(只写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| D. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
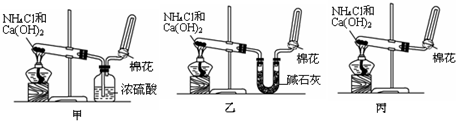
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应时,产物只有一种 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 金属与非金属发生反应时,被氧化的一定是金属 | |
| D. | 铁丝不论在空气中还是纯氧中都不会燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
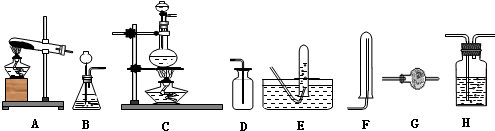
| 制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
| NH3 | H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com