
��10�֣��������ƣ�Na2Fe04����һ����������ˮ��������ij�о�С��������ù�ҵ����м��������ͭ��̼����ȣ���ȡ�������ƵĹ������̣�����X, Y, Z���Ǻ����Ļ����Na2C03����Һ

��l������м�м���̼��������Һ����Ҫ����������������
(2)��д������������Xת��ΪY�����ӷ���ʽ����������
(3��д��CI2��Z����ΪNa2Fe04�Ļ�ѧ����ʽ����������
(4)��������������Ļ�ԭ������о�ˮ���ã��Խ����侻ˮԭ����������
(5)��ҵ�����������ƻ����õ�ⷨ��![]() ������ʱ�����ĵ缫��Ӧʽ������������
������ʱ�����ĵ缫��Ӧʽ������������
��1����ϴ����м��������ۣ�
��2��2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O
��3��10NaOH + 3Cl2 + 2Fe(OH)3 == 2Na2FeO4 + 6NaCl + 8H2O
��4������������ɱ������ʱ����������ԭ��Fe3+��Fe3+��ˮ������Fe(OH)3�����н�������ʣ�������ˮ�е��������ʣ�������ˮ�����á���ֻ���Fe3+��ˮ������Fe(OH)3����1�֣�
��5��Fe��6e����8OH����FeO42����4H2O



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
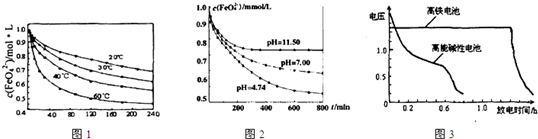
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com