
下列实验设计能够成功的是( )
| 选项 | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样 |
| B | 检验某盐是否为铵盐 | 试样 |
| C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样
|
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
现代科技的高度快速发展离不开C和Si元素。
(1)写出Si的基态原子核外电子排布式__________________。
(2)从电负性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为______。
(3)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_____,微粒间存在的作用力是_______。
(4)C、Si为同一主族的元素,CO2 、SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种绿色、可再生的新能源。下图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔Pt电极)。该电池工作时,下列说法不正确的是( )
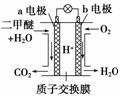
A.a电极为该电池正极
B.当有0.4 mol电子转移时,b极消耗2.24 L O2
C.电池工作时,a电极反应式:CH3OCH3-12e-+3H2O===2CO2↑+12H+
D.电池工作时,燃料电池内部H+从a电极移向b电极
查看答案和解析>>
科目:高中化学 来源: 题型:
用试纸检验气体性质是一种重要的实验方法。如图所示的实验中(可加热),下列试纸的选用、现象及对应结论都正确的一项是( )
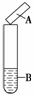
| 选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
| A | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | Cu,浓硝酸 | 淀粉KI试纸 | 变蓝 | NO2为酸性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.化学反应中的能量变化,都表现为热量的变化
B.需要加热才能发生的反应,一定是吸收能量的反应
C.释放能量的反应在常温下一定很容易发生
D.是吸收能量的反应还是释放能量的反应,须看反应物的总能量和生成物的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列体系加压后,对化学反应速率没有明显影响的是( )
A.2SO2(g)+O2(g)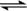 2SO3(g)
2SO3(g)  B.I2(g)+H2(g)
B.I2(g)+H2(g)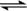 2HI(g)
2HI(g)
C.CO2(g)+H2O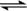 H2CO3 D.H++OH-
H2CO3 D.H++OH- 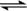 H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
简答:
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72- + H2O 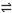 2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1) 向上述溶液中加入NaOH溶液,溶液呈_________色,因为加入NaOH溶液反应中________的浓度________(填增大或减小)平衡向_____ _方向移动, 的浓度增大, 的浓度减小。
(2)向原溶液中逐滴加入Ba(NO3)2 溶液(已知BaCrO4为黄色沉淀),则平衡
向 移动,溶液 颜色将_______________ 。
颜色将_______________ 。
(3) 在一定条件下,N2 和H2发生如下反应:
N2(g) + 3H2 (g)  2NH3 (g) ΔH =-92.4 kJ/mol
2NH3 (g) ΔH =-92.4 kJ/mol
①该反应中ΔH的含义是
A.该反应达到平衡时放出的热量
B.该反应达到平衡时吸收的热量
C.该条件下,N2 和H2反应生成2molNH3时放出的热量
D.该条件下,N2 和H2反应生成2molNH3时吸收的热量
②达到平衡后,在其他条件不变的情况下降低温度,正逆化学反应速率都
(填增大、减小或不变),平衡向 方向移动;重新
建立新的平衡后,在其他条件不变的情况下增大压强,正逆化学反应速
率都 (填增大、减小或不变),平衡向 方向移动。若平衡后,在其他条件不变的情况下加入催化剂,正逆化学反应速率都
(填增大、减小或不变),平衡 移动(填是或否)。
“中和热”是热化学中的一个重要概念。在稀溶液里,酸、碱发生中和反应生成1mol 水,这时反应放出的热叫中和热。以下关于中和热的叙述,正确的是
A.在稀溶液中所有酸和碱反应的中和热都相等
B.在稀溶液中强酸和强碱反应的中和热都相等
C.在稀溶液中1mol 酸和1mol 碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠浓液中刚好生成1mol 水时,产生的热量即中和热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com