
分析 (1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,氮气和氢气的转化率之比始终相等;
(2)平均相对分子质量=$\frac{气体总质量}{气体总物质的量}$,ρ=$\frac{m}{V}$,据此进行计算;
(3)充入氩气并保持压强不变,体积变大,各组分浓度减小.
解答 解:(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的转化率之比为1:1,
故答案为:1:1;
(2)升温,平衡逆向移动,气体物质的量增大,质量不变,气体的平均相对分子质量=$\frac{气体总质量}{气体总物质的量}$,所以混合气体的平均相对分子质量减小;
因容器体积不变,气体总质量不变,所以混合气体的密度不变,
故答案为:变小;不变;
(3)充入氩气并保持压强不变,体积变大,相关气体的分压变小,相当于减小压强,平衡向体积增大的逆向移动,
故答案为:逆向.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学反应速率、平均相对分子质量的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 都是有机物 | B. | 都不溶于水 | ||
| C. | 有一种气态物质,其余均是液体 | D. | 除一种外均是四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
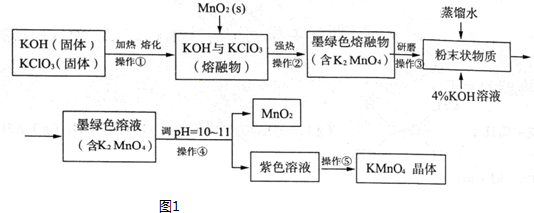
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
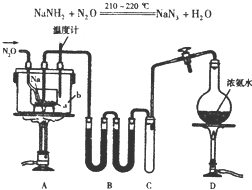 NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
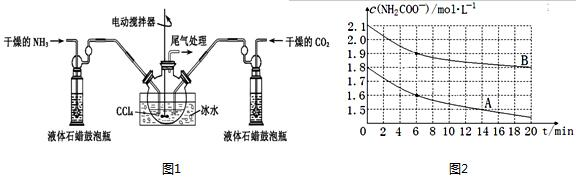
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-) | B. | n(NH4+) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z浓度之比为1:2:2 | |
| C. | 容器内气体混合物的压强不随时间变化 | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com