
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌为活泼金属,加入硫酸铜发生Zn+CuSO4=ZnSO4+Cu,置换出铜;
(2)Cu、Zn、硫酸形成原电池反应,会使得化学反应速率加快;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同;
②生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
解答 解:(1)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,此外金属锌会和硫酸之间发生反应Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4,
故答案为:Ag2SO4;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升高反应温度;适当增加硫酸的浓度;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml,
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(5)小题,首先V1、V6、V9的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯水应保存在棕色试剂瓶内:2HClO$\frac{\underline{\;光照\;}}{\;}$H2O+Cl2↑ | |
| B. | 氯水具有杀菌、漂白作用:Cl2+H2O?HCl+HClO | |
| C. | 将氯水滴到淀粉KI试纸上,试纸变蓝:Cl2+2I-=2Cl-+I2 | |
| D. | 在实验室用漂白液和适量稀盐酸制取少量氯水:ClO-+Cl-+2H+=Cl2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
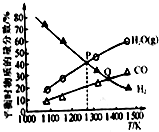 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )| A. | 容器内的总压:P点<Q点 | |
| B. | 正反应速率:v(Q)<v(P) | |
| C. | P点对应温度时,H2的平衡转化率为40% | |
| D. | P点对应温度的平衡常数的值为2.5×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率与逆反应速率相等且为零 | |
| B. | A、B、C的浓度不再变化 | |
| C. | A、B、C的物质的量相等 | |
| D. | A、B、C的分子数目比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤 |
| ① | 向新制的Na2S溶液中滴加新制的氯水 |
| ② | 将镁条投入1mol/L的稀盐酸中 |
| ③ | 将铝条投入1mol/L的稀盐酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com