
����Ŀ����ҵ����������(��Ҫ�ɷ�ΪAl2O3��Fe2O3��SiO2)��ȡ��������ұ������ԭ�ϣ���ȡ�IJ����������£�
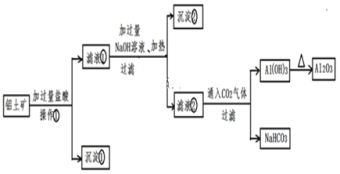
��ش��������⣺
(1)�����ٵ����ƣ�____________��
(2)�����ڵĻ�ѧʽ��____________��
(3)д����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��__________��
(4)д����Һ����ͨ�����CO2�����ɳ��������ӷ���ʽ�� ______���ܷ���Һ����ͨ�����CO2���ɼ��������� ____ (����������)����������_______(�û�ѧ����ʽ��ʾ)��
����ˮAlCl3���������������л��ϳɵĴ����ȡ���ҵ����������Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������£�
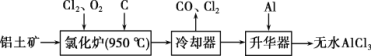
(1)���ڿ������н�ǿ�Ŀ���ʴ�ԣ�ԭ����___________________________��
(2)�Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ___________________________��
(3)Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ(������FeCl3)�Ĵ��ȣ���ȡ16g��ˮAlCl3��Ʒ���ڹ�����NaOH��Һ�У����˳�����������ᆳϴ�ӡ����ա���ȴ�����أ���������Ϊ0.32g��
��д���������ӹ������漰�����ӷ���ʽ______________��_______________��
�ڲ�Ʒ��AlCl3����������Ϊ___________��(������λ��Ч����)
���𰸡����� Fe(OH)3 SiO2+2NaOH=Na2SiO3+H2O ![]() +CO2+2H2O=Al(OH)3��+
+CO2+2H2O=Al(OH)3��+![]() ���� Al(OH)3 +3HCl= AlCl3 +3H2O ���ڿ����л��γ�һ�����ܵ�����Ĥ����ֹ���һ������ Al2O3+3Cl2+3C
���� Al(OH)3 +3HCl= AlCl3 +3H2O ���ڿ����л��γ�һ�����ܵ�����Ĥ����ֹ���һ������ Al2O3+3Cl2+3C![]() 2AlCl3+3CO Fe3++3OH-=Fe(OH)3�� Al3++4OH=
2AlCl3+3CO Fe3++3OH-=Fe(OH)3�� Al3++4OH=![]() +2H2O 96%
+2H2O 96%
��������
�������̿�֪�������ᣬֻ��SiO2����Ӧ�����������������������ᷴӦ��������Ϊ���ˣ�������ΪSiO2����Һ���мӹ���NaOH��������ת��Ϊƫ�����ƣ�������ת�����������˺�����ΪFe(OH)3����Һ�ں�NaOH��ƫ�����ƣ��������̼��Ӧ��������������̼�����ƣ�������������ֽ��������������Դ������
���ݹ������̿�֪�Ȼ�¯�IJ������ȴ���������Ʊ���ˮAlCl3��˵���Ȼ�¯�IJ����к���A1C13��������β������CO������Al2O3��C12��C��Ӧ������A1C13��CO��A1C13Ϊ���ۻ��������������Ҫ����AlCl3��FeCl3��FeCl3�۵㡢�е�ϸߣ������Ʊ���ˮAlCl3����������AlĿ���dz�ȥFeCl3��
��(1)������������֪�������ٵ����ƣ����ˣ�
(2) ������������֪�������ڵĻ�ѧʽΪFe(OH)3��
(3)��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪSiO2+2NaOH=Na2SiO3+H2O��
(4) ��Һ�ں�NaOH��ƫ�����ƣ�ͨ�����CO2���壬����Al(OH)3������NaHCO3�������ɳ��������ӷ���ʽΪ![]() +CO2+2H2O=Al(OH)3��+
+CO2+2H2O=Al(OH)3��+![]() ��Al(OH)3�������������������ǿ���ǿ����Һ������Һ��������������ᣬ����Al(OH)3�������ɣ�������Ӧ�Ļ�ѧ����ʽΪAl(OH)3 +3HCl= AlCl3 +3H2O���ʲ����ù�������������CO2���壻
��Al(OH)3�������������������ǿ���ǿ����Һ������Һ��������������ᣬ����Al(OH)3�������ɣ�������Ӧ�Ļ�ѧ����ʽΪAl(OH)3 +3HCl= AlCl3 +3H2O���ʲ����ù�������������CO2���壻
��(1) ���ڿ����л��γ�һ�����ܵ�����Ĥ����ֹ���һ��������˵�����ڿ������н�ǿ�Ŀ���ʴ������
(2) ���ݹ������̿�֪�Ȼ�¯�IJ������ȴ���������Ʊ���ˮAlCl3��˵���Ȼ�¯�IJ����к���A1C13��������β������CO������Al2O3��C12��C��Ӧ������A1C13��CO����Ӧ����ʽΪAl2O3+3Cl2+3C![]() 2AlCl3+3CO��
2AlCl3+3CO��
(3) �ٳ��ӹ����������������������ӽ�ϳ��������������������������������ӽ�ϳ�ƫ�������ˮ��������Ӧ�����ӷ���ʽΪFe3++3OH-=Fe(OH)3����Al3++4OH-=AlO2-+2H2O��
��0.32g����ɷ�ΪFe2O3�������ʵ���Ϊ![]() =0.002mol������ԭ���غ㣬��֪������FeCl3�����ʵ���Ϊ0.005mol�����Ʒ��AlCl3����������Ϊ
=0.002mol������ԭ���غ㣬��֪������FeCl3�����ʵ���Ϊ0.005mol�����Ʒ��AlCl3����������Ϊ![]() ��96%��
��96%��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ������·�����NaOH��Һ��ȡNa2CO3��10H2O��
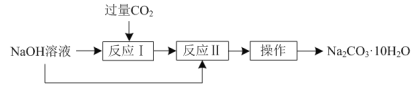
��1������Ӧ�����Ļ�ѧ����ʽΪ___��
��2������Ӧ���������ӷ���ʽΪ___��
��3����������������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ( )
A.�ø����pH��ֽ�ⶨ��ˮ��pH
B.����һ��Ũ�ȵ�NaOH��Һ������ʱ���Ӷ�����ʹ���Ƶ���ҺŨ��ƫС
C.�ü��ȷֽ�ķ����ɽ�NH4Cl�����Ca(OH)2����Ļ�������
D.��25.0 g CuSO4��5H2O����100 mL����ˮ�У�����100 mL 1.0 mol/L CuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�124 g P4������P��P����ĿΪ4NA
B. 100 mL 1mol��L1FeCl3��Һ������Fe3+����ĿΪ0.1NA
C. ��״���£�11.2 L�������ϩ������к���ԭ����ĿΪ2NA
D. �ܱ������У�2 mol SO2��1 mol O2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��N2O4֮�䷢����Ӧ��N2O4![]() 2NO2��һ���¶��£����Ϊ2L���ܱ������У������ʵ����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
2NO2��һ���¶��£����Ϊ2L���ܱ������У������ʵ����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
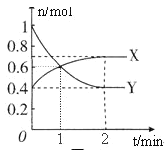
(1)����____________(����X������Y��)��ʾNO2�����ʵ�����ʱ��ı仯���ߡ���0��1min������X��ʾ�÷�Ӧ��������________________���÷�Ӧ�������ʱY��ת����_______��
(2)��������Ӧ�ڼס���������ͬ������ͬʱ���У��ֱ��ü��� v(NO2)��0.3 mol��L��1��min��1������y(N2O4)��0.2 mol��L��1��min��1����__________�з�Ӧ���졣
(3)���������ܱ�ʾ��Ӧ��ƽ��״̬����______________________��
A��������X��Y�����ʵ������
B���������������ɫ���ٸı�
C��2v(X)��v(Y)
D�������������ƽ����Է����������ٸı�
E��������������ܶȲ��ٷ����仯
(4)NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ������ͼ���õ����ʹ�ù�����ʯī���缫������������Y(N2O5)����ʯīI�缫��______________(��������������������)��ʯī���ĵ缫��ӦʽΪ_________________________________��
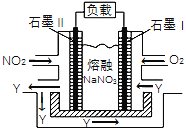
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����( )��
A.��Ũ������������̷�Ӧ��ȡ����������MnO2+4HCl![]() Mn2+ + 2Cl-+ Cl2��+2H2O
Mn2+ + 2Cl-+ Cl2��+2H2O
B.��NaHCO3��Һ�еμ�����Ca(OH)2��![]() + Ca2+ + OH�T CaCO3��+ H2O
+ Ca2+ + OH�T CaCO3��+ H2O
C.������ˮ��Ӧ��Cl2 + H2O �T 2H+ + Cl- +ClO-
D.NaClO��Һ��ͨ��������SO2��3ClO��+H2O+SO2�TCl��+![]() +2HClO
+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��Ũ������ֳ������ʣ������У���Ӧ��ϵ��ȷ���ǣ� ��
A. �ڿ����г��ھ��õ�Ũ���ᣬ��Һ��������![]() �ѻӷ���
�ѻӷ���![]()
B. �ڼ���������ͭ��Ũ���ᷴӦ![]() ǿ�����ԡ�����
ǿ�����ԡ�����![]()
C. ������Ũ���ᷴӦ���к���״��̿����![]() ��ˮ��
��ˮ��![]()
D. Ũ�������������������ϣ���������ɫ��ɰ�ɫ![]() ��ˮ��
��ˮ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaSO4������Һ�У�����Na2SO4(s)���ﵽ�ܽ�ƽ��ʱ�����й�ϵʽ��ȷ����( )
A. c(Ba2��)��c(SO42-)
B. c(Ba2��)��c(SO42-)��c(Ba2��)��c(SO42-)��Ksp(BaSO4)
C. c(Ba2��)��c(SO42-)��[Ksp(BaSO4)]1/2
D. c(Ba2��)��c(SO42-)��c(Ba2��)��c(SO42-)��Ksp(BaSO4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ��ǿ������Ư���������ֽ⡣���������Ʊ�����������ʵ����ͼ��
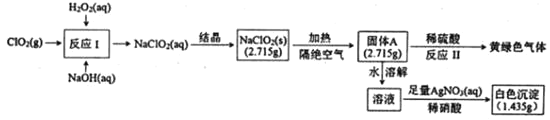
��֪���ٹ���AΪ���ֺ�������ɵĻ�����AgClO3��AgcClO4������ˮ��
��ش�
��1��˫��ˮ�ĵ���ʽΪ___������A�ijɷ���___���û�ѧʽ��ʾ����
��2����ӦI�����ӷ���ʽΪ___��
��3����Ӧ��Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com