
【3分】在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )

| A(干燥气体) | B(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4 mol·L-1 NaOH溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | 1 mol·L-1 盐酸 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【16分】今有某学生设计的用催化氧化法制取少量HNO3溶液的实验装置,如下图所示。

请回答下列问题。
(1)实验室制备NH3,下列方法中宜选用的是________(填序号)
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③生石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为______________;在实验过程中,加热Pt丝红热后,移去酒精灯,发现Pt丝还继续保持红热,由此可判断该反应是_____________________。
(3)装置C的作用是__________;装置C中的现象是__________;为确保D中尽可能多生成HNO3,所通入O2和NH3的体积比应大于__________。
(4)氨在高温下催化氧化时还有副反应发生:4NH3+3O2![]() 2N2+6H2O。若忽略装置中残留的气体体积,测得D中有1.0 mol·L-1的HNO3溶液150 mL,气球中收集的混合气体体积为400 mL(标准状况),其中NO2、O2与N2的体积比为2∶2∶1,则氧化成NO的氨占被氧化的体积分数为_________。
2N2+6H2O。若忽略装置中残留的气体体积,测得D中有1.0 mol·L-1的HNO3溶液150 mL,气球中收集的混合气体体积为400 mL(标准状况),其中NO2、O2与N2的体积比为2∶2∶1,则氧化成NO的氨占被氧化的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省仪征市大仪中学高三第一次涂卡训练化学试卷(带解析) 题型:实验题
水滑石化学式为:[Mg6Al2(OH)16CO3]·4H2O(相对分子质量为602),是环保型阻燃剂。它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。
在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
【查阅资料】水滑石与稀硫酸反应的化学方程式为:
[Mg6Al2(OH)16CO3]·4H2O+9H2SO4==6MgSO4+Al2(SO4)3+CO2↑+21H2O。药片中除了水滑石外含有一定量的辅料——淀粉等物质。
【提出猜想】小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
【设计方案】他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了下图所示的实验装置。取10.0g市售的水滑石药片研磨成粉末,进行实验。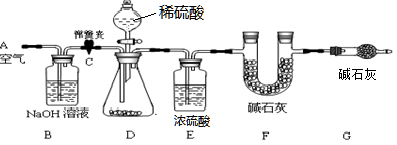
【说明】碱石灰是氧化钙和氢氧化钠固体的混合物。B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %。(写出计算过程)
【方案评价】在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省仪征市高三第一次涂卡训练化学试卷(解析版) 题型:实验题
水滑石化学式为:[Mg6Al2(OH)16CO3]·4H2O(相对分子质量为602),是环保型阻燃剂。它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。
在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
【查阅资料】水滑石与稀硫酸反应的化学方程式为:
[Mg6Al2(OH)16CO3]·4H2O+9H2SO4==6MgSO4+Al2(SO4)3+CO2↑+21H2O。药片中除了水滑石外含有一定量的辅料——淀粉等物质。
【提出猜想】小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
【设计方案】他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了下图所示的实验装置。取10.0g市售的水滑石药片研磨成粉末,进行实验。

【说明】碱石灰是氧化钙和氢氧化钠固体的混合物。B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %。(写出计算过程)
【方案评价】在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
【交流与讨论】
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
【问题一】如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O ,过滤、晾干。
【问题二】工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品―― 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com