
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、所用容量瓶不干燥 |
| n |
| V |
| n |
| V |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
| A、CO2中混有HCl(NaOH溶液) |
| B、FeCl3溶液中混有FeCl2(Cl2) |
| C、SiO2中混有Fe2O3(盐酸) |
| D、Fe2O3中混有SiO2(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
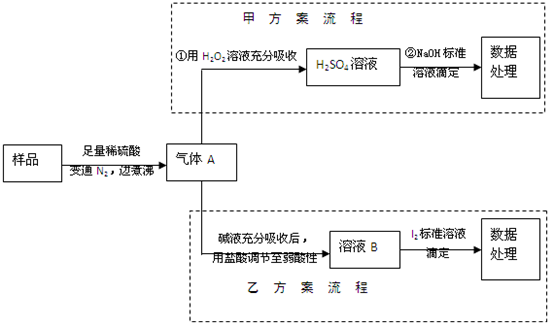
查看答案和解析>>
科目:高中化学 来源: 题型:
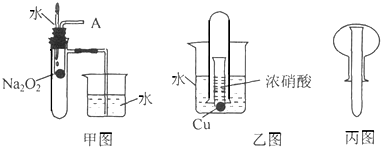
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列对其化学性质的判断中,不正确的是( )
,下列对其化学性质的判断中,不正确的是( )| A、能被银氨溶液氧化 |
| B、能使高锰酸钾溶液褪色 |
| C、1mol该有机物只能与1molBr2发生加成反应 |
| D、1mol该有机物只能与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 +H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化.
+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 乙醇酯化 | 乙醇氧化 | 乙醛氧化 | 油脂皂化 | 多肽水解 |
| A | O-H | C-H | C-H | C-O | C-N |
| B | O-H | O-H | O-H | C-O | C-H |
| C | C-O | C-O | C-H | C═O | C═O |
| D | C-O | C-H | C-C | C-O | N-H |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com