
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | 绚丽缤纷的烟花与原子核外电子发生跃迁吸收能量有关 | |
| C. | 叶绿素、血红素和维生素B12都是配合物 | |
| D. | 当单一波长的X-射线通过石英玻璃时,在记录仪上可看到分立的斑点或谱线 |
分析 A.同素异形体是同种元素组成的不同单质;
B.钠的焰色是原子的发射光谱,与原子核外电子发生跃迁有关;
C.含有配位键的化合物是配合物;
D.石英玻璃是非晶体.
解答 解:A.14C和12C质子数相同,中子数不同互为同位素,都是碳元素的原子,不是单质,不是同素异形体,故A错误;
B.电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化,当钠在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故B错误;
C.含有配位键的化合物是配合物,所以血红素、叶绿素、维生素B12都是配合物,故C正确;
D.当单一波长的X-射线通过晶体时,会在记录仪上看到分立的斑点或谱线,而同一条件下摄取的非晶体图谱中看不到分立的斑点或明锐的谱线,故D错误.
故选C.
点评 本题考查同素异形体、电子跃迁、配合物以及X-射线等,注意当单一波长的X-射线通过晶体时,会在记录仪上看到分立的斑点或谱线,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 HA溶液与0.1 mol•L-1 NaOH溶液混合至溶液呈中性:c(Na+)>c(A-) | |
| B. | 0.1 mol•L-1 HA溶液中:c(H+)=c(OH-)+c(A-) | |
| C. | 0.1 mol•L-1 NaA溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 0.1 mol•L-1 HA溶液中加入少量NaA固体,HA的电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与I•的浓度有关 | B. | M是该反应的催化剂 | ||
| C. | 反应①与②的活化能相等 | D. | v(H2)=v(I2)=v(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A.元素原子的核外p电子总数比s电子总数少1 |
| B.元素价电子排布式为nsnnp2n |
| C.元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| D.原子核外所有p轨道全满或半满 |
| E.元素的主族序数与周期数的差为4 |
| F.是前四周期中电负性最小的元素 |

 ;1mol B22+中含有的π键数目为2NA.
;1mol B22+中含有的π键数目为2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
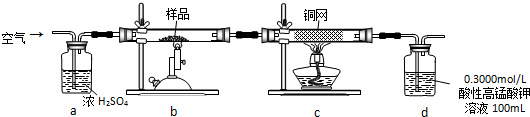
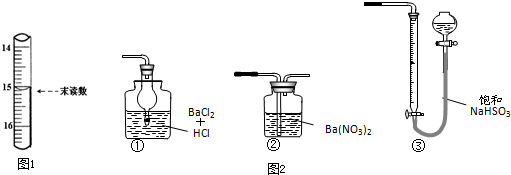
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com