
X、Y、Z、W是短周期的4种元素,有关他们的信息如下表所示.
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n﹣3(n为原子核外电子层数) | 化学反应中,W原子易失去最外层电子形成与Ne原子电子层结构相同的Wn+ |
填写下列空白(提示:不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的结构式是 ,Z元素在周期表中的位置是 .
(2)X、Y、Z三元素的最高价氧化物对应的水化物酸性由强到弱的顺序是 .
(3)常温时,W的硫酸盐溶液的pH 7(填“=”“>”或“<”).理由是 (用离子方程式表示).
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是 (用离子方程式表示).
(5)W与氧化铁反应的化学方程式 .
| 位置结构性质的相互关系应用. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | X、Y、Z、W是短周期的四种元素,X的单质由双原子分子构成,分子中有14个电子,X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存,故X为氮元素;Y原子的次外层电子数等于最外层电子数的一半,Y有2个电子层,最外层电子数为4,Y能形成多种气态氢化物,则Y为碳元素;Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价代数和等于6,则Z最外层有7个电子,故Z为氯元素;W原子的最外层电子数等于2n﹣3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,则2n﹣3=n,解得n=3,则W为铝元素,据此答题. |
| 解答: | 解:X、Y、Z、W是短周期的四种元素:X的单质由双原子分子构成,分子中有14个电子,X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存,故X为氮元素;Y原子的次外层电子数等于最外层电子数的一半,Y有2个电子层,最外层电子数为4,Y能形成多种气态氢化物,则Y为碳元素;Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价代数和等于6,则Z最外层有7个电子,故Z为氯元素;W原子的最外层电子数等于2n﹣3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,则2n﹣3=n,解得n=3,则W为铝元素.故X为氮元素;Y为碳元素;Z为氯元素;W为铝元素. (1)X为氮元素,X的气态氢化物为NH3,氮原子与氢原子之间形成1对共用电子对,结构式为 (2)X为氮元素、Y为碳元素、Z为氯元素,非金属性越强,最高价氧化物的水化物酸性越强,非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3, 故答案为:HClO4>HNO3>H2CO3; (3)W的硫酸盐为硫酸铝,硫酸铝是强酸弱碱盐,常温时,铝离子水解 Al3++3H2O 故答案为:<; Al3++3H2O (4)X的氢化物为NH3,W的氢氧化物为Al(OH)3,用氨水制取Al(OH)3的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+, 故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+; (5)W为铝,与氧化铁发生铝热反应,反应的化学方程式为2Al+Fe2O3 |
| 点评: | 本题以元素推断为载体,考查结构式等化学用语、铝热反应、盐类水解、元素周期律、元素化合物性质等,综合性较大,难度中等,是对所学知识的综合性考查,注意基础知识的理解掌握.推断元素是解题关键. |


科目:高中化学 来源: 题型:
请按要求填空。
(1)根据要求对下列物质进行分类(填序号)
A.CH3CH=CHC(CH3) B.CH2ICH=CHCH2I
C.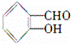 D.HOCH2CH=CHCH2COOH
D.HOCH2CH=CHCH2COOH
属于烃的是 ;属于卤代烃的是 ;
既属于醛又属于酚的是 ;既属于醇又属于羧酸的是 .
(2)下列各组物质属于同系物的是_____,属于同分异构体的是______,属于同素异形体的是_____,属于同位素的是______,属于同一种物质的是_________。
①O2和O3 ②氕和氚 ③麦芽糖和蔗糖 ④苯和对二甲苯
⑤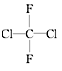 和
和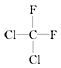 ⑥
⑥ ⑦C2H2和C4H6
⑦C2H2和C4H6
⑧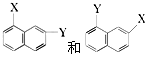 ⑨乙醇和二甲醚 ⑩淀粉和纤维素
⑨乙醇和二甲醚 ⑩淀粉和纤维素
⑾CH3CH2NO2和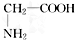 ⑿ 2-甲基-1,3-丁二烯和异戊二烯
⑿ 2-甲基-1,3-丁二烯和异戊二烯
(3)化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A 的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如下图。
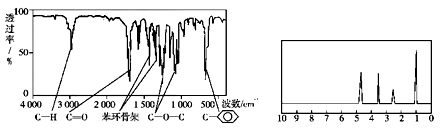
则A的结构简式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置、选用的试剂或实验操作中,都正确的是( )
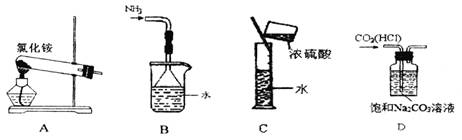
A.实验室用装置A制取氨气 B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸 D.用D装置除去CO2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是( )
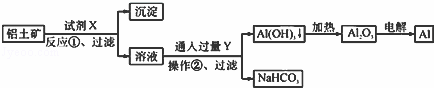
|
| A. | 试剂X可以是盐酸 |
|
| B. | 反应①过滤后所得沉淀为氢氧化铁 |
|
| C. | 图中所示转化反应都不是氧化还原反应 |
|
| D. | 操作②中发生的化学方程式为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K= 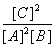
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
右图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是 D
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com