

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
分析 (1)①醋酸是一元弱酸,在水溶液中部分电离生成醋酸根离子和氢离子;
②加水稀释、进入和醋酸反应的物质或加热都促进醋酸电离;
(2)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大;
②酸和碱都对水的电离起抑制作用,酸、碱性越强,水的电离程度越小;
③醋酸钠显示碱性,氯化钠显示中性;
④0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,据此确定离子浓度大小;
(3)①铁离子遇到硫氰化钾因发生反应而显示红色;
②银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀;
③沉淀向着更难溶的方向转化.
解答 解:(1)①醋酸是一元弱酸,在水溶液中部分电离生成醋酸根离子和氢离子,其电离方程式为CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
②加水稀释、进入和醋酸反应的物质或加热都促进醋酸电离,进入盐酸或醋酸钠都产生同离子效应而抑制醋酸电离,故选BC;
(2)①由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
故答案为:I;
②0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1醋酸溶液,
故答案为:0.1mol•L-1醋酸溶液;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2,故答案为:<;
④用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-),故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)①铁离子遇到硫氰化钾显示红色,发生的反应为:Fe3++3SCN-?Fe(SCN)3,故答案为:Fe3++3SCN-?Fe(SCN)3;
②加入硝酸银,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀,故答案为:出现白色沉淀;
③AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,沉淀会向着更难溶的方向转化,即Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,
故答案为:AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
点评 本题考查酸碱混合溶液定性判断及难溶物的溶解平衡等知识点,为高频考点,侧重考查学生图象分析、实验分析判断能力,明确化学反应原理、物质性质是解本题关键,知道影响弱电解质电离程度的因素,题目难度中等.


科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ⑧ | |||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,说明该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8和C5H10 | B. | C3H8和C4H10 | ||
| C. | C2H4O2和C3H6O2 | D. | C6H5OH和C6H5CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
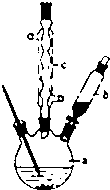 苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: (苯乙腈)
(苯乙腈)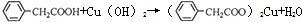
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol C | B. | 1mol B、3mol C | ||
| C. | 1.5mol B和1.5mol C | D. | 2mol A、2mol B和3mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
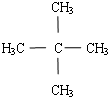 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
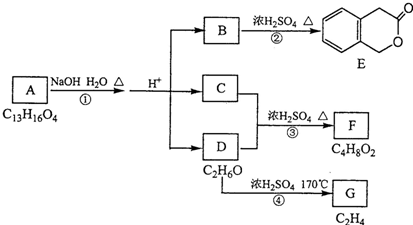
 .反应①的反应类型是水解反应或取代反应.
.反应①的反应类型是水解反应或取代反应. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com