
(1)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
(2)已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
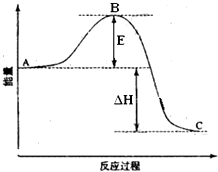 Ⅰ同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算.
Ⅰ同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算.| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(4分)(1)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
(2)已知:① C(s)+O2(g)=CO2(g); DH=—393.5kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北唐山市第一中学高二年级调研考试化学试卷 题型:填空题
(4分)(1)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+ O2(g)=
O2(g)=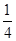 P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
(2)已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
查看答案和解析>>
科目:高中化学 来源:2013届河北唐山市高二年级调研考试化学试卷 题型:填空题
(4分)(1)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
(2)已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com