
| A. | 117a3ρ | B. | $\frac{M}{{{N_A}{a^3}}}$ | C. | $\frac{234}{{{a^3}ρ}}$ | D. | $\frac{58.5}{{2{a^3}ρ}}$ |
分析 氯化钠的摩尔体积=$\frac{M}{ρ}$,根据氯化钠的摩尔体积和一个NaCl的体积的关系式计算阿伏伽德罗常数.
解答 解:氯化钠的摩尔体积=$\frac{M}{ρ}$=$\frac{58.5g/mol}{ρg/c{m}^{3}}$=$\frac{58.5}{ρ}c{m}^{3}/mol$,而在氯化钠晶体中,每个小正方体中含有$\frac{1}{2}$个NaCl,所以一个NaCl的体积是2a3cm3,1mol物质含有的微粒是阿伏伽德罗常数个,所以阿伏加德罗常数的值=$\frac{氯化钠的摩尔体积}{1个氯化钠的体积}$=$\frac{\frac{58.5}{ρ}c{m}^{3}/mol}{2{a}^{3}c{m}^{3}}$=$\frac{58.5}{2{a}^{3}ρ}$/mol,故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在光照条件下,体积比为1:1的CH4和Cl2充分反应可以制取CH3Cl | |
| B. | 乙烯和苯都可与溴水发生加成反应 | |
| C. | 用新制氢氧化铜可以检验淀粉是否完全水解 | |
| D. | 分子式同为C3H7Cl,但沸点不同的分子共有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
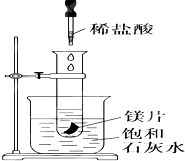 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中,丁元素的原子半径最小 | |
| B. | 气态氢化物的稳定性:乙>丙 | |
| C. | 同浓度的最高价含氧酸溶液的H+浓度丁>丙 | |
| D. | 元素甲和丙形成的两种常见化合物均为强还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com