
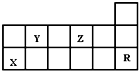
| A. | 热稳定性:Y的气态氢化物<Z的气态氢化物 | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R元素的单质化学性质活泼 |
分析 由元素在周期表中的位置可知,R为Ar,则X为Al,Y为C,Z为O,结合元素及其单质、化合物的性质来解答.
解答 解:由元素在周期表中的位置可知,R为Ar,则X为Al,Y为C,Z为O,
A.非金属性越强,气态氢化物越稳定,则非金属性Z>Y,热稳定性为Y的气态氢化物<Z的气态氢化物,故A正确;
B.X为Al,其对应最高价氧化物的水化物为两性氢氧化物,酸性弱于碳酸,故B错误;
C.Al与浓硫酸和硝酸反应不能生成氢气,故C错误;
D.R为Ar,最外层电子数为8,不容易失去和得到电子,化学性质稳定,故D错误;
故选:A.
点评 本题考查位置、结构、性质的关系,明确元素在周期表中的位置及元素周期律是解答本题的关键,题目难度不大,注意稀有气体在周期表中的位置即可解答.


科目:高中化学 来源: 题型:解答题
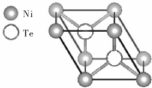 氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题:
氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题: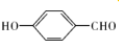 的沸点比
的沸点比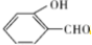 高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.
高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
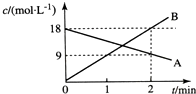
| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
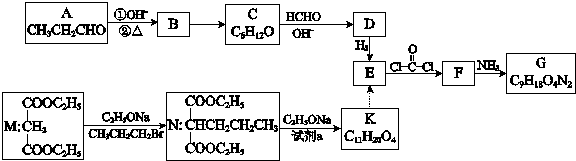
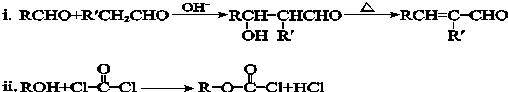
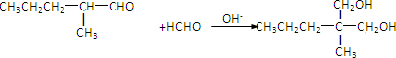 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M分子式为C6H6O7 | |
| B. | 1 mol物质M可以和3 mol氢气发生加成 | |
| C. | M分子不可以发生消除反应 | |
| D. | 足量的M分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 该反应中的能量变化可用如图来表示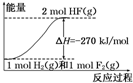 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
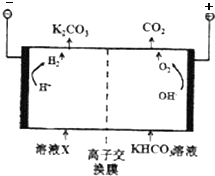 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ•mol-1 | 890.3 | 1299.6 | 285.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com