

| A. | 反应①②中都存在:△S>0 | B. | 反应②高温时,可自发进行 | ||
| C. | 在通常情况下,①②都能自发进行 | D. | 反应①一定不能自发进行 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 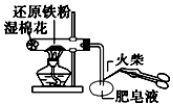 验铁粉与水蒸气反应产生的氢气 | |
| B. |  分离两种互溶但沸点相差较大的液体混合物 | |
| C. |  乙酸乙酯的制备演示实验 | |
| D. |  碳酸氢钠受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-,能够大量共存 | |
| C. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:M<N<Q<R | |
| B. | W中的阴阳离子个数比为1:1,属于离子化合物 | |
| C. | Q的某单质可作水的消毒剂,该单质在大气中含量越多,对人体越有益 | |
| D. | M和N、Q均能形成既含极性键又含非极性键的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | 2CH3CH2OH+O2$\stackrel{Cu,△}{→}$2CH3CHO+2H2O | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-a}{2a-b}$ | B. | $\frac{a-b}{2b-a}$ | C. | $\frac{2a-b}{b-a}$ | D. | $\frac{2a+b}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com