
| A | B | C | D | |
| 强电解质 | HF | HClO4 | Ba(OH)2 | 食盐水溶液 |
| 弱电解质 | Cu(OH)2 | NH3•H2O | BaSO4 | HClO |
| 非电解质 | Cu | SO2 | 蔗糖 | H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物,非金属氧化物、大多数的有机物(如蔗糖、乙醇等);
单质,混合物既不是电解质也不是非电解质.
解答 解:A、HF是弱电解质,铜是金属单质不是电解质,故A错误;
B、HClO4 是强酸属于强电解质,NH3•H2O是弱碱属于弱电解质,SO2 是非金属氧化物本身不能电离出离子属于非电解质,故B正确;
C、Ba(OH)2 是强碱属于强电解质,BaSO4 是盐属于强电解质,蔗糖是非电解质,故C错误;
D、食盐水是氯化钠的水溶液属于混合物,既不是电解质液不是非电解质,HClO是弱酸属于弱电解质,H2O是弱电解质,故D错误;
故选B.
点评 本题考查了强弱电解质的判断,明确电解质的相关概念、掌握影响弱电解质电离平衡,非电解质实质理解是解本题关键,题目难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
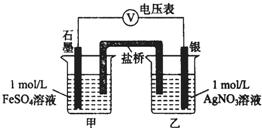 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL1mol/L AgNO3溶液加入到 1mL1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL2mol/LFe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/LFe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL2mol/LFeCl3溶液加入有银镜的试管中 | 银镜消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢燃料电池汽车的使用可以有效减少城市空气污染 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 发展氢燃料电池汽车不需要安全高效的储氢技术 | |
| D. | 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
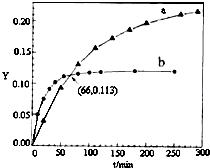 已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法不正确的是( )
已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法不正确的是( )| A. | b代表20℃下CH3COCH3的Y-t曲线 | |
| B. | 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的$\frac{△n(0℃)}{△n(20℃)}$=1 | |
| C. | 升高温度可缩短反应达平衡的时间并能提高平衡转化率 | |
| D. | 反应进行到20min末,CH3COCH3的$\frac{v(0℃)}{v(20℃)}$<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 液态HCl不能导电,属于共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com