
| A. | 合金的性能一般优于纯金属 | |
| B. | 碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀 | |
| C. | 酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜 | |
| D. | 用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强 |
分析 A.合金与组成它的成分相比,一般具有熔点低、硬度大、抗腐蚀性强等方面的优点;
B.碳素钢在空气中更容易形成原电池,发生电化学腐蚀;
C.氧化铝的熔点高,包裹在Al的外面;
D.铝活泼性强于钒,且铝热反应放出大量的热,可冶炼高熔点金属.
解答 解:A.合金与组成它的成分相比,一般具有熔点低、硬度大、抗腐蚀性强等方面的优点,性能一般优于纯金属,故A正确;
B.碳素钢在空气中更容易形成原电池,发生电化学腐蚀,所以碳素钢在空气中比纯铁耐腐蚀查,故B错误;
C.将一片铝箔置于酒精灯外焰上灼烧生成氧化铝,氧化铝的熔点高,包裹在Al的外面,则铝箔熔化但不滴落,故C正确;
D.铝热反应可冶炼高熔点金属,可用金属铝与V2O5在高温下冶炼矾,铝作还原剂,常温下不反应,故D正确;
故选:B.
点评 本题考查了金属材料的性能与应用,明确合金的概念及性质,熟悉铝热反应原理,金属腐蚀与防护是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数116 | B. | 中子数177 | ||
| C. | 电子数116 | D. | 该原子可表示为:${\;}_{116}^{177}$Lv |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
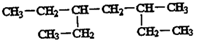 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )| A. | 该有机物属于烷烃 | |
| B. | 该有机物与3-甲基-5-乙基辛烷互为同系物 | |
| C. | 该有机物与2,5-二甲基一3-乙基己烷互为同分异构体 | |
| D. | 该有机物命名时,主链上的碳原子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
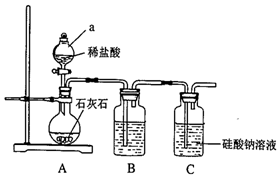 某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:
某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
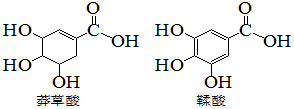
| A. | 莽草酸分子式为C7H10O5 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子互为同系物 | |
| D. | 等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
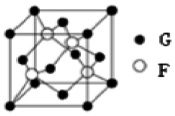 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
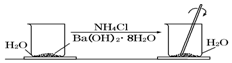 在研究化学反应中的能量变化时,我们通常做下面的实验:
在研究化学反应中的能量变化时,我们通常做下面的实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com