
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 二氧化碳通入澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 氢氧化钡溶液与盐酸混合OH-+H+═H2O |
分析 A.不符合反应客观事实;
B.原子个数不守恒;
C.二氧化碳通入澄清石灰水中反应生成碳酸钙和水;
D.二者反应生成氯化钡和水.
解答 解:A.铁粉与稀硫酸反应生成二价铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.二氧化碳通入澄清石灰水中,离子方程式:CO2+Ca2++2OH-═CaCO3↓+H2O,故C正确;
D.氢氧化钡溶液与盐酸混合,离子方程式:OH-+H+═H2O,故D正确;
故选:AB.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应须遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
 (1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作
(1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、氨、四氯化碳均为电解质 | |
| D. | 胶体、食用盐、点豆腐的卤水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从食盐溶液中获得食盐晶体采用过滤的方法 | |
| B. | 除去自来水中的Cl-可以采用蒸馏的方法 | |
| C. | 将碘晶体中含有的少量沙子除去,采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: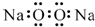 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: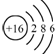 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度大小:硝基苯>水>苯 | |
| B. | 熔、沸点高低:乙醇>丁烷>丙烷 | |
| C. | 含碳量大小:乙烷>乙醇>乙酸 | |
| D. | 等质量燃烧时的耗氧量:乙烷>乙烯>丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com