
 �������ȣ�SOCl2����һ��Һ̬�Ĺ��ۻ�����е�78.8�棬�۵�-105��
�������ȣ�SOCl2����һ��Һ̬�Ĺ��ۻ�����е�78.8�棬�۵�-105������ ��1��2SOCl2��g��?SO2Cl2��g��+SCl2��g�� ���ɣ�������д����ӵõ�����ƽ�ⳣ��Ϊ����֮���ĵ���������ʽ��д����Ӧ�ȵķ����෴��
��2����27g SO2Cl2�����ʵ���Ϊ$\frac{27g}{135g/mol}$=0.02mol��6min�ﵽƽ��ʱSO2Cl2ת����Ϊ60%����ת����SO2Cl2Ϊ0.012mol����
SO2Cl2��g��?SO2��g��+Cl2��g��
��ʼ����mol����0.02 0 0
�仯����mol����0.012 0.012 0.012
ƽ������mol����0.008 0.012 0.012
�ٸ���v=$\frac{��c}{��t}$����v��Cl2����
�ڼ���ƽ��ʱ������������ʵ�����ѹǿ֮�ȵ������ʵ���֮�ȣ�
����Ҫ��Сת���ʣ���ͨ����С��������������ѹǿ�ķ�����
��3����Liʧ����Ϊ������SOCl2Ϊ�����������Ϸ����õ��ӵĻ�ԭ��Ӧ��
�ڵ��ʱ�������缫��ӦΪ��Һ������������������ʧ��������������4OH--4e-=2H2O+O2���������缫��ӦΪ��Cu2++2e-=Cu��2H++2e-=H2�����������������������ʵ�����ϵ������е����غ��������⣮
��� �⣺��1��2SOCl2��g��?SO2Cl2��g��+SCl2��g�� ���ɣ�������д����ӵõ�����ƽ�ⳣ��Ϊ����֮���ĵ�������K=$\frac{1}{{K}_{1}+{K}_{2}}$���÷�Ӧ��H=-��a+b��kJ/mol��
�ʴ�Ϊ��$\frac{1}{{K}_{1}+{K}_{2}}$��-��a+b����
��2����27g SO2Cl2�����ʵ���Ϊ$\frac{27g}{135g/mol}$=0.2mol��6min�ﵽƽ��ʱSO2Cl2ת����Ϊ60%����ת����SO2Cl2Ϊ0.12mol����
SO2Cl2��g��?SO2��g��+Cl2��g��
��ʼ����mol����0.2 0 0
�仯����mol����0.12 0.12 0.12
ƽ������mol����0.08 0.12 0.12
��v=$\frac{��c}{��t}$=$\frac{\frac{0.12mol}{2L}}{6min}$=0.01mol•L-1•min-1��
�ʴ�Ϊ��0.01mol•L-1•min-1��
��ƽ��ʱ�����ʵ���Ϊ��0.08mol+0.12mol+0.12mol=0.32mol����ƽ��ʱѹǿΪ��$\frac{0.32mol}{0.2mol}$��101kPa=161.6kPa��
�ʴ�Ϊ��161.6��
����Ҫ��Сת���ʣ���ͨ����С��������������ѹǿ�ķ�����Ҳ����ʼʱ��������ͬʱ����SO2Cl2��Cl2��SO2�ȣ�
�ʴ�Ϊ��������ѹǿ������С�����������
��3����Liʧ����Ϊ������SOCl2Ϊ�����������Ϸ����õ��ӵĻ�ԭ��Ӧ���������缫����ʽΪ��3SOCl2+8e-�T6Cl-+SO32-+2S��
�ʴ�Ϊ��3SOCl2+8e-�T6Cl-+SO32-+2S��
�ڵ��ʱ�������缫��ӦΪ��Һ������������������ʧ��������������4OH--4e-=2H2O+O2���������缫��ӦΪ��Cu2++2e-=Cu��2H++2e-=H2������������������״����448mL������ʱ�������ɵ�����Ϊ$\frac{0.448L}{22.4L/mol}$=0.02mol������ת�Ƶ���Ϊ0.08mol���ɵ����غ��֪�����ĵ�LiΪ0.08mol������Li������Ϊ0.08mol��7g/mol=0.56g��
�ʴ�Ϊ��0.56g��
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ������Ӧ�ȼ��㡢���ԭ����Ӧ�úͼ���ȣ���Ҫѧ���߱�֪ʶ�Ļ�������������������Ѷ��еȣ�ע��������η��ڻ�ѧƽ������е�Ӧ���Լ����غ�ԭ����е����غ��Ӧ�ã�


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д� Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȳ�ͱ� | B�� | һ����̼������ | C�� | ��Ȳ����ϩ | D�� | ������ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | һ������Al��������Ϊ2.7g | |
| B�� | һ�����У�NH4��2SO4��MgCl2�������ʵ������ | |
| C�� | һ������MgCl2��FeCl2 | |
| D�� | һ������FeCl2�����ܺ���MgCl2��AlCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ��1��3-����ϩ������ϩ��������ˮ�����ӳɷ�Ӧ | |
| B�� | ʵ������Ҫ��ȥ�����л��е���ϩ���壬������ͨ��H2������ķ��� | |
| C�� | �е��ɸߵ�������Ϊ�������飾�����飾�����飾�����飾�춡�� | |
| D�� | ���¹��������£�������CH4��������ȡ������һ�ȼ��飬�÷�Ӧ����ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
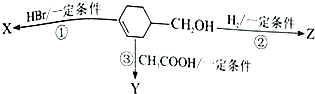 ���
�л���  �ɷ�������ͼʾ��Ӧ����֪����Y����֬�࣮����˵����ȷ���ǣ�������
�ɷ�������ͼʾ��Ӧ����֪����Y����֬�࣮����˵����ȷ���ǣ�������| A�� | ��Ӧ�۵�������ϡ���ᡢ���� | B�� | ��Ӧ�٢ڵ����Ͳ�������ͬ | ||
| C�� | �л�����X��һ�ִ����� | D�� | Y��Z����ʹ���Ը��������Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
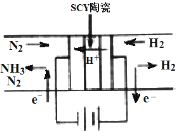 ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɽ���ĤΪ���ӵ��壬����ʵ���ڵ��³�ѹ�����µ绯ѧ�����ϳɰ����÷���N2��H2��ת����Զ�������ڹ�ҵ��ʹ�õİ��ϳɷ�����ʵ��ԭ����ͼ��ʾ�����й��ڵ绯ѧ�ϳɰ�����������ȷ���ǣ�������
��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɽ���ĤΪ���ӵ��壬����ʵ���ڵ��³�ѹ�����µ绯ѧ�����ϳɰ����÷���N2��H2��ת����Զ�������ڹ�ҵ��ʹ�õİ��ϳɷ�����ʵ��ԭ����ͼ��ʾ�����й��ڵ绯ѧ�ϳɰ�����������ȷ���ǣ�������| A�� | �����ĵ缫��Ӧ��N2+6H++6e-=2NH3 | |
| B�� | �������Ϻ��������϶���ѡ���� | |
| C�� | H2�������Ϸ�����Ӧ��H2-2e-=2H+ | |
| D�� | �ù��̵��ܷ�Ӧʽ��N2+3H2$\frac{\underline{\;���\;}}{\;}$2NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ϩ | B�� | ����ͱ�ϩ | C�� | �������ϩ | D�� | ����ͱ�ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 180Hfת��Ϊ185Hf�ǻ�ѧ�仯 | |
| B�� | ���ߵĺ���������ֱ�Ϊ108��113 | |
| C�� | 1mol 180Hf����������1mol 185Hf��5NA | |
| D�� | ��Ԫ�����ڱ��е�λ�ò�ͬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com