
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 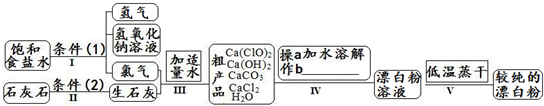 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
分析:(1)根据物质的量浓度计算公式c=
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数;碳酸钙在高温下会分解; (3)有元素化合价变化的反应是氧化还原反应,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂; (4)实现固体和液体的分离方法是过滤; (5)次氯酸钙在较高温度下不稳定; (6)氯酸钙以和空气中的水以及二氧化碳反应; (7)氯气和水反应生成盐酸和次氯酸; (8)次氯酸根离子具有氧化性,溴离子具有还原性,在酸性环境下会发生氧化还原反应. 解答:解:(1)物质的量浓度计算公式c=
(2)电解饱和食盐水的反应为化:2NaCl+2H2O
 ,碳酸钙在高温下会分解,故答案为: ,碳酸钙在高温下会分解,故答案为: ;高温; ;高温;(3)有元素化合价变化的反应为氧化还原反应,流程III中发生两个反应,一个是氯气和氢氧化钙反应生成氯化钙、水以及次氯酸钙的反应,即2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,属于氧化还原反应,一个是次氯酸钙和水以及二氧化碳反应生成碳酸钙和次氯酸的反应,即Ca(ClO)2+CO2+H2O═CaCO3+2HClO,属于复分解反应,一定不是氧化还原反应,在氯气和氢氧化钙的反应中,化合价升高元素Cl所在的反应物氯气是还原剂,化合价降低的Cl元素所在的反应物氯气是氧化剂,故答案为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O; Cl2; Cl2; (4)流程IV中加水溶解后过滤可以实现固体难溶物和液体的分离,故答案为:过滤; (5)次氯酸钙在较高温度下不稳定,易分解,所以流程V进行低温蒸干,故答案为:Ca(ClO)2在100°C时发生分解反应; (6)较纯的次氯酸钙粉末必须密封保存,因为氯酸钙以和空气中的水以及二氧化碳反应而变质,即Ca(ClO)2+CO2+H2O═CaCO3+2HClO,故答案为:Ca(ClO)2+CO2+H2O═CaCO3+2HClO; (7)氯气和水反应生成盐酸和次氯酸,反应的方程式是:Cl2+H2O  HCl+HClO, HCl+HClO,故答案为:Cl2+H2O  HCl+HClO; HCl+HClO;(8)次氯酸根离子具有氧化性,溴离子具有还原性,在酸性环境下会发生氧化还原反应:Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O,故答案为:Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O. 点评:本题是一道综合知识的考查题目,要求学生具有分析和解决问题的能力,难度大,综合性强.  
练习册系列答案
相关习题
科目:高中化学 来源: 题型: 漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.如图为制取漂白粉的工业流程简图. 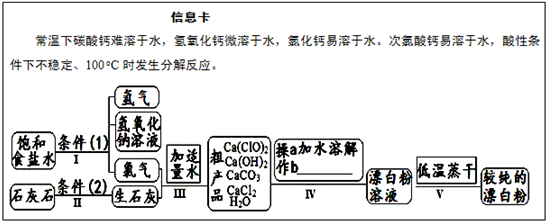 (1)流程 I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程 I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程 III中发生两个反应,写出其中一个的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .(4)流程 IV中操作b是: 过滤 过滤 .(写名称)(5)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .查看答案和解析>> 科目:高中化学 来源: 题型:解答题 漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.如图为制取漂白粉的工业流程简图.查看答案和解析>> 科目:高中化学 来源:不详 题型:填空题 漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.如图为制取漂白粉的工业流程简图. 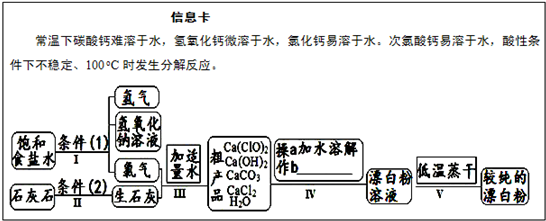 (1)流程 I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是______ mol?L-1. (2)写出流程 I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:______.流程 II的反应条件(2)是______. (3)流程 III中发生两个反应,写出其中一个的氧化还原反应的化学反应方程______. (4)流程 IV中操作b是:______.(写名称) (5)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因______. 查看答案和解析>> 科目:高中化学 来源:2011-2012学年江苏省常州市金坛市高一(上)期中化学试卷(解析版) 题型:解答题 漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.下图为制取漂白粉的工业流程简图.
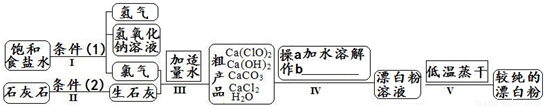 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是______ mol?L-1. (2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:______.流程II的反应条件(2)是______. (3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程______.其中氧化剂是______;还原剂是______.(写化学式) (4)流程IV中操作b是:______.(写名称) (5)流程V进行低温蒸干的原因是:______. (6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因______. (7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式______. (8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式:______. 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |