
磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂。
已知: SO2Cl2(g) SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO₂(g) +Cl₂(g)+ SCl₂(g) 2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+ SCl₂(g)  2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应
2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应
△H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5 g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 ,平衡时容器内压强为 kPa,该温度的平衡常数为 ;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是 (列举一种)。
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为 ;亚硫酰氯溶于水的离子方程式为 。
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为 ;
已知常温时次氯酸的Ka=2.5×10-8则该温度下NaClO水解反应的平衡常数
Kb= mol·L-1
(1)K1·K2 ;a+b
(2)0.004mol·L-1·min-1;181.8kPa;0.16mol·L-1;增大压强(或缩小容器体积)
(3)SO2Cl2+4NaOH = Na2SO4 + 2NaCl + 2H2O;SOCl2 + H2O = SO2↑+ 2H++2Cl-
(4)c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+);4×10-7
【解析】(1)SO2Cl2(g)+ SCl₂(g)  2SOCl2(g) 是由(Ⅰ)、(Ⅱ)相加得到,故平衡常数为两之积,反应热为两者之和。
2SOCl2(g) 是由(Ⅰ)、(Ⅱ)相加得到,故平衡常数为两之积,反应热为两者之和。
(2)生成Cl2的物质的量为0.08mol,其浓度为0.04mol,故速率为0.004mol·L-1·min-1;平衡时总物质的量为:0.02mol+0.08mol+0.08mol=0.18mol,故平衡时压强为:0.18mol/0.1mol×101kPa=181.8kPa;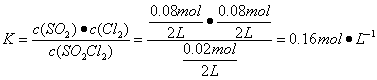 ;若要减小转化率,可通过缩小容器体积即增大加压强的方法,也可起始时再容器中同时充入SO2Cl2和Cl2或SO2。
;若要减小转化率,可通过缩小容器体积即增大加压强的方法,也可起始时再容器中同时充入SO2Cl2和Cl2或SO2。
(3)SO2Cl2中硫为+6价,氯为-1,氢氧化钠足量时生成硫酸盐和盐酸盐;SOCl2中硫为+4价,水解生成SO2及HCl。(4)Cl2+ 2NaOH = NaCl + NaClO+H2O,显然c(Na+)最大,考虑到ClO-水解显碱性,故c(Cl-)>c(ClO-),c(OH-)>c(H+);HClO的电离常数与ClO-之积等于水的离子积,故Kb=Kw/Ka=4×10-7。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是:
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,装置正确且能达到实验目的的是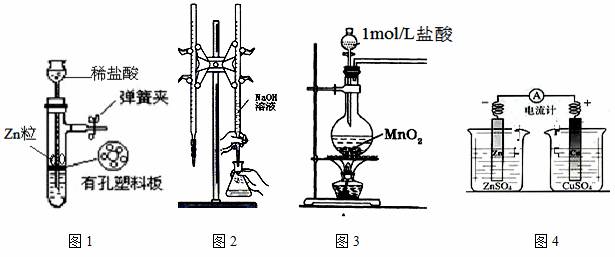
A.用图1所示装置制取少量H2
B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度
C.用图3所示装置制取少量Cl2
D.用图4所示装置确定导线中有电流通过及并确定电流方向
查看答案和解析>>
科目:高中化学 来源: 题型:
| T | ||
| X | Y | Z |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是( )
A.R位于元素周期表中第二周期第VA族
B.R能分别与X、Z形成共价化合物
C.气态氢化物稳定性:Y>T
D.Z元素的最高价氧化物对应的水化物的化学式为HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
[有机化学基础]
颠茄酸酯(J)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,其合成路线如下:
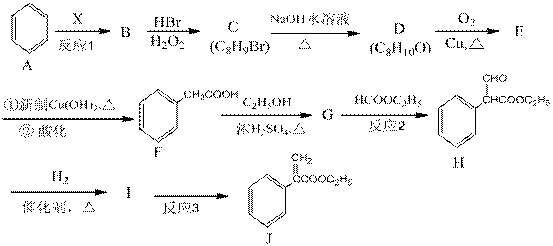
回答下列问题:
(1)烃B中含氢的质量分数为7.69%,其相对分子质量小于118,且反应1为加成反应,则B的分子式为___________,X的化学名称为 。
(2)C→D的反应类型为_____________,G→H 的反应类型为_____________。
(3)D的结构简式为___________________,G的结构简式为_______________________。
(4)反应3的化学方程式为_______________________________________________________。
(5)J的核磁共振氢谱有__________个峰。
(6)化合物I有多种同分异构体,同时满足下列条件的结构有 种。
①能发生水解反应和银镜反应
②能与FeCl3溶液发生显色反应
③苯环上有四个取代基,且苯环上一卤代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )
A.减少CO2的排放,可以减少酸雨的产生
B.减少SO2的排放,可以从根本上消除雾霾
C.“天宫一号”使用的碳纤维,是一种新型有机高分子材料
D.用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年,“安全”是人们关注的热点。以下做法能合理有效提高“食品安全”的是( )
A.食品加工,禁止使用化学添加剂
B.食品包装,用聚乳酸材料替代聚乙烯
C.蔬菜种植,禁止使用化肥和农药
D.饮水处理,用高铁酸钾替代氯气和明矾
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O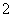 ,每个O
,每个O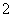 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com