
| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯易溶于水 |
分析 同主族元素金属性从上到下依次增强,单质熔点依次减弱,最高价氧化物水化物碱性依次增强,与水反应剧烈程度依次增强,据此解答.
解答 解:A.铯与钠都是碱金属,铯位于钠的下方,单质熔点铯低于钠,故A错误;
B.同主族元素金属性从上到下依次增强,最高价氧化物水化物碱性依次增强,铯位于钠的下方,所以CsOH比NaOH的碱性强,故B正确;
C.同主族元素金属性从上到下依次增强,与水反应剧烈程度依次增强,铯位于钠的下方,Cs与H2O能剧烈反应,甚至发生爆炸,故C正确;
D.同主族元素性质具有相似性,碱金属碳酸盐都易溶于水,所以碳酸铯易溶于水,故D正确.
故选:A.
点评 本题考查了碱金属的性质,题目难度不大,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
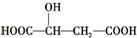 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )| A. | 每生成2molAB分子吸收b kJ热量 | |
| B. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 1molA-A键和1molB-B键的总键能高于2molA-B键的总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子化合物 | ||
| C. | Tl(OH)3是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定大于弱电解质溶液的导电能力 | |
| B. | 溶于水能导电的化合物都是电解质 | |
| C. | 25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度 | |
| D. | BaSO4属于强电解质,所以其水溶液导电能力很强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、铁、氯化氢 | B. | 生石灰、白磷、纯碱 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、胆矾(CuSO4•5H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com