
(1)ĻąĶ¬ĪļÖŹµÄĮæµÄO2ŗĶO3£¬Ėłŗ¬·Ö×ÓŹżÄæÖ®±ČĪŖ_______,Ėłŗ¬ŃõŌ×ÓµÄĪļÖŹµÄĮæÖ®±ČĪŖ_________”£
(2)ŌŚ±ź×¼×“æöĻĀ£¬¢Ł4 g H2£®¢Ś11.2 L O2£®¢Ū1 mol H2OÖŠ£¬ŗ¬Ō×ÓŹż×ī¶ąµÄŹĒ_ ___£¬Ģå»ż×īŠ”µÄŹĒ_______”££ØĢīŠņŗÅ£©
(3)±źæöĻĀ£¬½«224LµÄHClĘųĢåČÜÓŚ835ml£Ø¦Ń=1g/cm3£©µÄĖ®ÖŠ£¬ĖłµĆŃĪĖįµÄĆܶČĪŖ1.2g/cm3£¬ øĆŃĪĖįµÄĪļÖŹµÄĮæÅضČ___________.”£
(4)ijĘųĢåĪļÖŹÖŹĮæĪŖ6.4 g£¬ŗ¬ÓŠ6.02”Į1022øö·Ö×Ó£¬ŌņøĆĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ_______”£
(5)Na2CO3µÄĦ¶ūÖŹĮæŹĒ____________£¬0.5mol Na2CO3µÄÖŹĮæŹĒ____________£¬ŗ¬ÓŠ________mol Na+£¬Na+µÄøöŹżŌ¼ĪŖ___________”£
(1) 1:1 2:3 (2) ¢Ł£¬ ¢Ū (3) 10 mol•L‾1
(4) 64 (5) 106g/mol£¬ 53g£¬1mol£¬ 6.02”Į1023”£(ĆææÕ1·Ö£¬µ„Ī»²»Š“²»øų·Ö)
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©O2ŗĶO3µÄĪļÖŹµÄĮæĻąĶ¬£¬ŌņO2ŗĶO3µÄ·Ö×ÓŹżĻąµČ£¬ĖłŅŌ·Ö×ÓŹżÄæÖ®±ČĪŖ1:1£»O2·Ö×ÓÖŠŗ¬2øöOŌ×Ó£¬O3·Ö×ÓÖŠŗ¬3øöOŌ×Ó£¬¹ŹĖłŗ¬ŃõŌ×ÓµÄĪļÖŹµÄĮæÖ®±ČĪŖ2:3”£
£Ø2£©4g H2ĪŖ4g”Ā2g/mol=2mol£¬HŌ×ÓĪŖ4mol£¬±ź×¼×“æöĻĀ11.2L O2ĪŖ11.2L”Ā22.4L/mol=0.5mol£¬OŌ×ÓĪŖ1mol£¬1mol H2Oŗ¬3molŌ×Ó£¬ĖłŅŌŌ×ÓŹż×ī¶ąµÄ¢Ł4 g H2£»H2OŌŚ±ź×¼×“æöĻĀ²»ŹĒĘųĢ壬ĖłŅŌĢå»ż×īŠ”µÄŹĒ1 mol H2O”£
£Ø3£©øł¾ŻĪļÖŹµÄĮæÅØ¶Č¶ØŅåŹ½½ųŠŠ¼ĘĖć£¬c(HCl)=224L”Ā22.4L/mol”Ā[(224L”Ā22.4L/mol”Į36.5g/mol+ 835ml”Į1g/cm³)”Ā1200g/L]=10mol•L‾1”£
£Ø4£©6.02”Į1022øö·Ö×ÓĪļÖŹµÄĮæĪŖ£ŗ6.02”Į1022”Ā6.02”Į1023mol-1=0.1mol£¬Ä¦¶ūÖŹĮæĪŖ6.4g”Ā0.1mol=64g/mol£¬ŌņøĆĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ64”£
£Ø5£©øł¾ŻĻą¶ŌŌ×ÓÖŹĮææÉĒó³öNa2CO3µÄĦ¶ūÖŹĮæĪŖ106g/mol£»Ōņ0.5mol Na2CO3µÄÖŹĮæĪŖ£ŗ0.5mol”Į106g/mol=53g£»ŗ¬ÓŠ1mol Na+£»Na+µÄøöŹżŌ¼ĪŖ6.02”Į1023”£
æ¼µć£ŗ±¾Ģāæ¼²éÓŠ¹ŲĪļÖŹµÄĮæµÄ¼ĘĖć”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| a |
| 2-a |
| a |
| 2-a |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
|
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
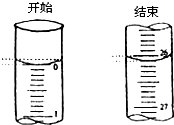 Ä³Ń§ÉśÓūÓĆŅŃÖŖĪļÖŹµÄĮæÅØ¶ČµÄŃĪĖįĄ“µĪ¶Ø²ā¶ØĪ“ÖŖĪļÖŹµÄĮæÅØ¶ČµÄĒāŃõ»ÆÄĘČÜŅŗŹ±£¬Ń”Ōń·ÓĢŖ×÷ÖøŹ¾¼Į£®ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ
Ä³Ń§ÉśÓūÓĆŅŃÖŖĪļÖŹµÄĮæÅØ¶ČµÄŃĪĖįĄ“µĪ¶Ø²ā¶ØĪ“ÖŖĪļÖŹµÄĮæÅØ¶ČµÄĒāŃõ»ÆÄĘČÜŅŗŹ±£¬Ń”Ōń·ÓĢŖ×÷ÖøŹ¾¼Į£®ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ| µĪ¶Ø“ĪŹż | “ż²āĒāŃõ»ÆÄĘ ČÜŅŗµÄĢå»ż/mL |
0.1000mol/LŃĪĖįµÄĢå»ż£ØmL£© | ||
| µĪ¶ØĒ°æĢ¶Č | µĪ¶ØŗóæĢ¶Č | ČÜŅŗĢå/mL | ||
| µŚŅ»“Ī | 25.00 | 0.00 | 26.11 | 26.11 |
| µŚ¶ž“Ī | 25.00 | 1.56 | 30.30 | 28.74 |
| µŚČż“Ī | 25.00 | 0.22 | 26.31 | 26.09 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĪŖĮĖĢįøßĆŗµÄČČŠ§Ó¦£¬Ķ¬Ź±¼õÉŁČ¼ÉÕŹ±µÄ»·¾³ĪŪČ¾£¬³£½«Ćŗ×Ŗ»ÆĪŖĖ®ĆŗĘų£¬ÕāŹĒ½«Ćŗ×Ŗ»ÆĪŖ½ą¾»Č¼ĮĻµÄ·½·ØÖ®Ņ»”£Ė®ĆŗĘųµÄÖ÷ŅŖ³É·ÖŹĒŅ»Ńõ»ÆĢ¼µÄĒāĘų£¬ĖüŹĒÓÉĆŗĢæŗĶĖ®ÕōĘų·“Ó¦ÖĘµĆ£¬ŅŃÖŖC£ØŹÆÄ«£©”¢CO”¢H2Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
C£Øs£¬ŹÆÄ«£©+O2£Øg£© CO2£Øg£©”÷H1=£393.5kJ?mol-1
H2£Øg£©+![]() O2£Øg£©
O2£Øg£© H2O£Øg£©”÷H2=£241.8kJ?mol-1
CO£Øg£©+O![]() 2£Øg£©
2£Øg£© CO2£Øg£©”÷H3=£283.0kJ?mol-1
H2£Øg£©+![]() O2£Øg£©
O2£Øg£© H2O£Ø1£©”÷H4=£285.8kJ?mol-1
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł øł¾ŻÉĻŹöĢį¹©µÄČČ»Æѧ·½³ĢŹ½¼ĘĖć£¬36gĖ®ÓÉŅŗĢ¬±ä³ÉĘųĢ¬µÄČČĮæ±ä
»ÆŹĒ ”£
¢ŚŠ“³öC£Øs£¬ŹÆÄ«£©ÓėĖ®ÕōĘų·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ ”£
¢Ū±ūĶéŹĒŅŗ»ÆŹÆÓĶĘųµÄÖ÷ŅŖ³É·ÖÖ®Ņ»£¬±ūĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
C3H8£Øg£©+5O2£Øg£© 3CO2£Øg£©+4H2O£Øg£©”÷H=£2220.0kJ?mol-1
ĻąĶ¬ĪļÖŹµÄĮæµÄ±ūĶéŗĶŅ»Ńõ»ÆĢ¼ĶźČ«Č¼ÉÕÉś³ÉĘųĢ¬²śĪļŹ±£¬²śÉśµÄČČĮæÖ®±ČĪŖ £»ĻąĶ¬ÖŹĮæµÄĒāĘųŗĶ±ūĶéĶźČ«Č¼ÉÕÉś³ÉĘųĢ¬²śĪļŹ±£¬²śÉśµÄČČĮæÖ®±ČĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
(1) ĻąĶ¬ĪļÖŹµÄĮæµÄO2ŗĶO3£¬Ėłŗ¬·Ö×ÓŹżÄæÖ®±ČĪŖ_________,Ėłŗ¬OµÄĪļÖŹµÄĮæÖ®±ČĪŖ_________”£
(2) ŌŚ±ź×¼×“æöĻĀ£¬4 g H2”¢11.2 L O2”¢1 mol H2OÖŠ£¬ŗ¬Ō×ÓŹż×ī¶ąµÄŹĒ______£¬Ģå»ż×īŠ”µÄŹĒ_______”£
(3) ±źæöĻĀ£¬½«224LµÄHClĘųĢåČÜÓŚ835ml£Ø¦Ń=1g/cm3£©µÄĖ®ÖŠ£¬ĖłµĆŃĪĖįµÄĆܶČĪŖ1.2g/cm3£¬ øĆŃĪĖįµÄĪļÖŹµÄĮæÅضČ___________
(4) ijĘųĢåĪļÖŹÖŹĮæĪŖ6.4 g£¬ŗ¬ÓŠ6.02”Į1022øö·Ö×Ó£¬ŌņøĆĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ__________
(5)Na2CO3µÄĦ¶ūÖŹĮæŹĒ____________,0.5mol Na2CO3µÄÖŹĮæŹĒ____________,ŗ¬ÓŠ________mol Na+,”””””””” ______mol CO3 2-,Na+µÄøöŹżŌ¼ĪŖ___________;Čō½«ĘäČÜÓŚĖ®,Åä³É250mLµÄČÜŅŗ,ŌņøĆČÜŅŗČÜÖŹµÄĪļÖŹµÄĮæÅضČĪŖ_____________;ČōĻņČÜŅŗÖŠ¼ÓČė¹żĮæµÄĻ”ŃĪĖį,²śÉśµÄĘųĢåĢå»żĪŖ(±źæöĻĀ)__________.
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com