
| A.防止硫酸铁分解 | B.抑制硫酸铁水解? |
| C.提高硫酸铁的溶解度 | D.提高溶液的PH |
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
| B.c(Na+)=2c(S2-)+c(OH-)+c(HS-) |
| C.向Na2S溶液中加水稀释,其所有离子的浓度都减小 |
| D.向溶液中加入少量NaOH固体,能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将纯水加热至较高温度,Kw变大、pH变小、呈酸性 |
| B.保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 |
| C.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
D.向0.1 mol·L-1氨水中加入少量水,pH减小,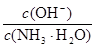 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑦ | B.②⑤⑦ |
| C.③⑥⑦ | D.全有关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
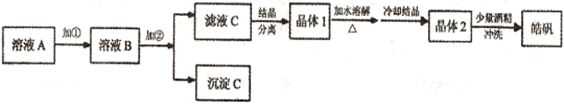 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。| | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
)>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+) )>c(B-)>c(A-)>c(H+) D. c(
)>c(B-)>c(A-)>c(H+) D. c( )>c(HB)>c(HA)>c(H+)
)>c(HB)>c(HA)>c(H+)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com