
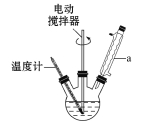
����Ŀ����������һ����Ҫ�Ļ���ԭ�ϡ�ʵ���Һϳɱ������ԭ�����й����ݼ�װ��ʾ��ͼ���£�
![]()
![]()
![]()
![]()
![]()
���� | ��״ | �۵�/�� | �е�/�� | �ܶ� /g��cm-3 | �ܽ��� | |
ˮ | �Ҵ� | |||||
�ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.866 9 | ���� | ���� |
������ | ��ɫƬ״����״���� | 112.4 (100����������) | 248 | 1.265 9 | �� | ���� |
��������ˮ�е��ܽ���������ʾ��
�¶�/�� | 4 | 18 | 75 |
�ܽ��/g | 0.2 | 0.3 | 2.2 |
ijѧϰС����ʵ�����Ʊ������롢�ᴿ�����ᣬ���ⶨ������Ʒ�Ĵ��ȣ��������£�
һ���Ʊ�������
��������ƿ�м���2.7 mL�ױ���100 mLˮ��2��3Ƭ���Ƭ�������綯��������a��ͨ������ˮ����ʯ�����ϼ��������ڣ�Ȼ���������8.5 g������أ���������Լ4��5 h��ֱ���ױ��㼸��������ʧ������Һ���ٳ������飬ֹͣ���Ⱥͽ��裬���á�
���������ᴿ
�ڷ�Ӧ������м���һ��������(H2C2O4)��ַ�Ӧ�����ˡ�ϴ�ӣ�����Һ���ڱ�ˮԡ����ȴ��Ȼ����Ũ�����ữ��������ȫ���������ѹ���ˣ�����������������ˮϴ�ӣ���ѹȥˮ�ֺ���ڷ�ˮԡ�ϸ���õ��ֲ�Ʒ��
�����ⶨ����
��ȡmg��Ʒ�����100 mL�Ҵ���Һ����ȡ25.00 mL��Һ����ƿ�У��μ�2��3�η�̪��Ȼ���ñ�Ũ��KOH��Һ�ζ���
��ش��������⣺
(1)װ��a��������________��������Ϊ_________________________________��
(2)�ױ����������������ԭ��Ϊ![]() +KMnO4
+KMnO4![]() +MnO2��+H2O+ ________������ɲ���ƽ�û�ѧ����ʽ��
+MnO2��+H2O+ ________������ɲ���ƽ�û�ѧ����ʽ��
(3)�����ᴿ�����м���IJ�����һ�ֶ�Ԫ���ᣬ��Ӧ����������ʽ�κ���ɫ�������ɡ���������������_______________________���������ӷ���ʽ��ʾ��Ӧԭ����__________________��
(4)��Ʒ��ѹ����ʱ����ˮϴ�ӵ�ԭ����_______________________________��
(5)ѡ������________(ѡ����ĸ)���������Խ��ֲ�Ʒ��һ���ᴿ��
A.����ˮ����� B.�����Ҵ�������
C.�üױ���ȡ���Һ D.����
(6)�ⶨ���Ȳ����У��ζ��յ���Һ����ɫ�仯��_________________________��
��m=1.200 g���ζ�ʱ��ȥ0.120 0 mol��L-1��KOH��Һ20.00 mL�������ò�Ʒ�б��������������Ϊ________��
������(1)���������� ������������ֹ�ױ��Ļӷ������Ͳ�Ʒ����
(2)1 2 1 2 1 KOH
(3)�������ĸ������ת��Ϊ�������̣��Ա���˳�ȥ 2Mn![]() +3H2C2O42MnO2��+2HC
+3H2C2O42MnO2��+2HC![]() +4CO2��+2H2O
+4CO2��+2H2O
(4)����������ˮ�е��ܽ�Ƚ�С������ˮϴ�ӿ��Լ��ٲ�Ʒ����ʧ
(5)D
(6)��Һ����ɫ��dz��ɫ���Ұ���Ӳ���ɫ 97.6%
��������(1)�÷�Ӧ�з�Ӧ������ﶼ�ӷ�����Ҫ�����������ܽ�������������
(2)�ױ�������Ϊ�����ᣬ�൱��������2����ԭ�ӡ�ȥ����2����ԭ�ӣ��ϼ�����6����KMnO4��3e-��MnO2��������![]() ��2KMnO4���ٽ��ԭ���غ���ƽ��
��2KMnO4���ٽ��ԭ���غ���ƽ��
(3)��Ӧ��������й�����KMnO4��������Ҳ����ˮ��������л�ԭ�ԵIJ��ὫKMnO4��ԭΪ���ܵĶ������̳�ȥ��ͬʱ������KHCO3��CO2��Mn![]() ��3e-��MnO2��H2C2O4��2e-��2CO2��(��HC)������ݵ�ʧ�����غ���2Mn
��3e-��MnO2��H2C2O4��2e-��2CO2��(��HC)������ݵ�ʧ�����غ���2Mn![]() ��3H2C2O4���ٽ�ϵ���غ㡢ԭ���غ���ƽ���ӷ���ʽ��
��3H2C2O4���ٽ�ϵ���غ㡢ԭ���غ���ƽ���ӷ���ʽ��
(4)���ݱ�������ˮ�е��ܽ��֪���¶�Խ�ͣ��ܽ��ԽС������ʱ��ʧԽ�١�
(5)ע����Ϣ����������100����������������ȵ�100�������ɵô����ı����ᣬ����ѡ���ж���ʹ�������ܽ�������롣
(6)����Һ�м����̪û�����������Լ���ʱ�ʺ�ɫ�����ݷ�Ӧ��n(������)=n(KOH)=0.120 0 mol��L-1��20.00 mL��10-3L��mL-1=2.4��10-3mol��m(������)=2.4��10-3mol��122 g��mol-1=0.292 8 g�����Ʒ�б����������������
0.292 8 g��4��1.200 g��100%=97.6%��


 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ������������е�ij���֣�K+��NH4+��Ba2+��SO42����I����AlO2�� �� �ֱ�ȡ��������pH�Ʋ��ԣ���Һ�������Ԣڼ���ˮ��CCl4���ã��²����ɫ��Ϊȷ������Һ����ɣ��������������ǣ� ��
A.K+
B.SO42��
C.Ba2+
D.NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮ�к���Zn2+��Hg2+��Fe3+��Cu2+���������ӡ��ס��ҡ�����λͬѧ��ƵĴӸ���ˮ�л��ս���ͭ�ķ������£�
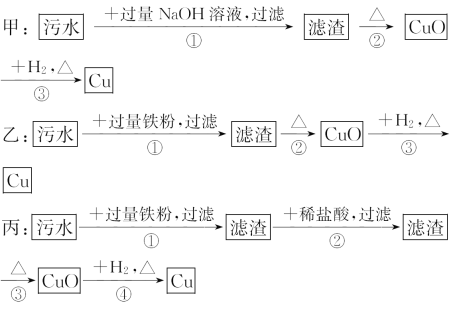
�����ж���ȷ����( )
A.����ʵ�鷽���ж����Ƶô�����ͭ
B.�ҷ����мӹ������ۿ��Խ�����������ȫ����ԭ
C.�����еķ�Ӧ�漰�û����ֽ⡢���ϡ����ֽ����ַ�Ӧ����
D.�����������������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ�������������ݵ�˵����ȷ����
A. ��������ƽ����ʳ�ε�����Ϊ12.35��
B. �ü�ʽ�ζ�����ȡ���������Һ20.00mL
C. ��pH��ֽ������������ϡ��Һ��pHΪ11.5
D. �к��ȵIJⶨʵ���У�NaOH��ҺӦ���Թ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����۵�Ϊ-107�棬�е�Ϊ12.5�棬��������м����֮��ļн�Ϊ120��������ˮ�⣬�й�������ȷ����
A. ������Һ̬ʱ�ܵ������̬ʱ������ B. �Ȼ�������ԭ�Ӳ���sp�ӻ�
C. �Ȼ������ӳ�ƽ�������Σ����Ǽ��Է��� D. ��������幹������NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��ܱ�������X��Y��Z��W��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����������˵��������ǣ�������
���� | X | Y | Z | W |
��ʼŨ��/molL��1 | 0.5 | 0.6 | 0 | 0 |
ƽ��Ũ��/molL��1 | 0.1 | 0.1 | 0.4 | 0.6 |
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ80%
B. �÷�Ӧ��ƽ�ⳣ������ʽΪk=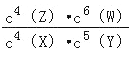
C. ����ѹǿ��ƽ�ⳣ�����䣬��ʹƽ��������Z�ķ����ƶ�
D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���̣����ڷ��ȷ�Ӧ���ǣ�������
A.NaOH����ˮ
B.����ȼ��
C.�ɱ�����
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�������������ԭ��Ӧԭ�����ǣ� ��
A.�û���̿������װ��������к�����
B.��K2Cr2O7���˾���Ƿ�ƺ�ݳ�
C.��������ϴ�մ������ϵ����⼣
D.��ʯ��ˮ����ȼú�����е�SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ����
A. �ö��Ե缫���MgCl2 ��Һ��2Cl��+2H2O![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
B. ���Ȼ�����Һ�еμ�������a2CO3��Һ��2Al3++3CO32-=Al2(CO3)3��
C. һ����������Һ�еμ�Ba(OH)2��Һ���������������ʱ��2Ba2++4OH��+Al3++2SO42��=2BaSO4��+AlO2��+2H2O
D. FeCl3��Һ��NaAlO2��Һ��ϣ�Fe3++ 3AlO2��=Fe(AlO2)3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com