
【题目】从铝土矿(成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下:
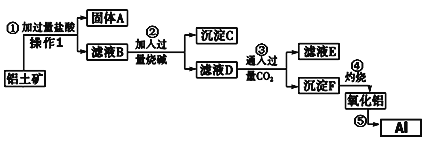
则回答下列问题:
(1)操作1的名称为____________,用到的玻璃仪器除玻璃棒、烧杯外,还需_________;
(2)沉淀C的成分为________________(写化学式);
(3)设计最简实验证明滤液D中Fe3+已沉淀完全(写出操作、现象及结论,试剂任选):取2mL滤液D于试管中,__________________________。
(4)滤液E中的主要溶质的化学式为________________;
(5)写出步骤⑤的化学方程式________________________。
【答案】过滤(洗涤、干燥) 漏斗 Fe(OH)3、Mg(OH)2 再向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全。(其它合理答案也可,如滴入NaOH无沉淀等) NaCl、NaHCO3 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据流程图,从铝土矿(成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝,铝土矿用盐酸溶解后得到的固体为SiO2,滤液B中含有铝离子、铁离子和镁离子,以及过量的盐酸,滤液B中加入过量烧碱,得到的沉淀为氢氧化铁和氢氧化镁,滤液D中含有偏铝酸钠,偏铝酸钠中通入过量二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,氢氧化铝灼烧后再电解生成金属铝。
(1)根据上述分析操作1的名称为过滤,过滤用到的玻璃仪器除玻璃棒、烧杯外,还需漏斗,故答案为过滤(洗涤、干燥);漏斗;
(2)沉淀C的中含有氢氧化铁和氢氧化镁,故答案为Fe(OH)3、Mg(OH)2;
(3)证明滤液D中Fe3+已沉淀完全的操作方法为:取2mL滤液D于试管中,向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全,故答案为向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全;
(4)根据上述分析,滤液E中的主要溶质有氯化钠和碳酸氢钠,故答案为NaCl、NaHCO3;
(5)步骤⑤是电解熔融氧化铝制取铝的反应,化学方程式为:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验,能达到相应实验目的的是( )
A.图2:收集NO2气体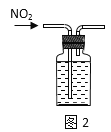
B.图3:验证X溶液为浓硝酸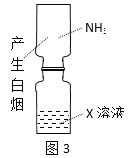
C.图4:验证氨气在水中的溶解性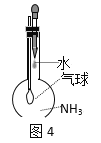
D.图5:用于吸收尾气NH3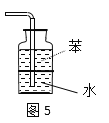
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对某未知溶液中离子的检验方法及其结论一定正确的是( )
A.加入稀盐酸产生无色气体,一定含有![]()
B.加入氯化钡溶液产生白色沉淀,一定含有![]()
C.加入碳酸钠溶液产生白色沉淀,一定含有Ca2+
D.取溶液进行焰色反应显黄色,一定含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)第2周期的8种元素中,第一电离能介于①元素和③元素间的元素有__种。
(2)表中能形成两性氢氧化物的元素是___(填元素名称![]() ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
(3)②、⑤、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)___。
(4)④元素与⑩元素两者质子数之差是___。
(5)请写出③的气体氢化物发生催化氧化的化学方程式___。
(6)请写出⑥元素的最高价氧化物的水化物与⑧元素的最高价氧化物的水化物反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
A.若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大
B.若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动
C.若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色
D.若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构式可用“键线式”简化表示。如CH3一CH=CH一CH3可简写为![]() 。有机物X的键线式为:
。有机物X的键线式为: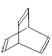 。下列说法不正确的是
。下列说法不正确的是
A.X与苯中碳元素的质量分数相同
B.有机物Y是X的同分异构体,且属于芳香烃,能使溴水褪色,则Y为苯乙烯
C.X能使酸性高锰酸钾溶液褪色
D.X 与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:

Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
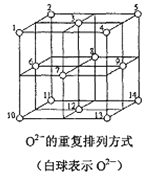
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com