
【题目】三氯氧磷((POCl3)可用于制备增塑剂,常温下为无色透明液体,易挥发,易水解。一中化学兴趣小组探究制备POCl3所需的装置如下图所示:

反应原理:PCl3+Cl2+H2O![]() POCl3+2HCl(PC13常温下为液态,易挥发)。
POCl3+2HCl(PC13常温下为液态,易挥发)。
(1)仪器3的名称是 _________,仪器2中装入的物质为______,仪器I的作用是_____.
(2)请选择上述必要装置并组装,用小写字母连接:________________________。
(3)开始通入氯气。同时慢慢滴加水,控制氯气和水的质量比在3.94左右,理由是:________________________.
(4)上述装置有一处不足,请指岀该不足:__________________________.
(5)上述反应剩余PCl3可以继续通入Cl2,再和P4O10反应,也可以产生的POC13 .。 写出该反应的化学方程式:__________________________________ .
【答案】恒压漏斗 浓盐酸 冷凝POCl3,防止挥发 a→f→g→d→e→h→i→b→c 1mol Cl2参与反应,需要1mol 水参与反应,水的用量过多会导致生成的三氯氧磷发生水解,水太少,会使三氯氧磷浓度过大而挥发 B装置是用来吸收未参与反应氯气的尾气处理装置,会发生倒吸 6PCl3+ 6Cl2+ P4O10= 10POC13
【解析】
(1)仪器3的名称是恒压漏斗,根据反应原理,制备三氯氧磷需要三氯化磷和氯气,仪器2中装入的物质为浓盐酸用于制取氯气,三氯氧磷((POCl3)和PC13常温下易挥发,仪器I的作用是冷凝POCl3和PC13,防止挥发;
答案为:恒压漏斗;浓盐酸;冷凝POCl3,防止挥发;
(2)A装置制取的氯气经过一系列除杂,通入到E装置中和PC13反应制取三氯氧磷,仪器连接的进出口顺序为:a→f→g→d→e→h→i→b→c;
答案为:a→f→g→d→e→h→i→b→c;
(3)反应原理:PCl3+Cl2+H2O![]() POCl3+2HCl可以得知,1mol Cl2参与反应,需要1mol 水参与反应,1mol Cl2和1mol 水的质量比为3.94左右,水的用量过多会导致生成的三氯氧磷发生水解,水太少,会使三氯氧磷浓度过大而挥发,1mol Cl2和1mol 水的质量比为3.94左右;
POCl3+2HCl可以得知,1mol Cl2参与反应,需要1mol 水参与反应,1mol Cl2和1mol 水的质量比为3.94左右,水的用量过多会导致生成的三氯氧磷发生水解,水太少,会使三氯氧磷浓度过大而挥发,1mol Cl2和1mol 水的质量比为3.94左右;
答案为:1mol Cl2参与反应,需要1mol 水参与反应,水的用量过多会导致生成的三氯氧磷发生水解,水太少,会使三氯氧磷浓度过大而挥发;
(4)上述装置有一处不足,即B装置是用来吸收未参与反应氯气的尾气处理装置,氯气易溶于水,和氢氧化钠反应,会发生倒吸现象。应该使用倒扣的漏斗或球形干燥管代替导管。
答案为:B装置是用来吸收未参与反应氯气的尾气处理装置,会发生倒吸;
(5)上述反应剩余PCl3可以继续通入Cl2生成PCl5,PCl5再和P4O10反应生成POC13 .。反应的化学方程式: 6PCl3+ 6Cl2+ P4O10= 10POC13;
答案为:6PCl3+ 6Cl2+ P4O10= 10POC13;


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。下列说法中不正确的是

A.装置C的作用是除去氯气中的杂质HCl
B.装置F中的现象为有白色沉淀产生
C.实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯
D.该实验中体现了浓盐酸的还原性和酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定 O2含量,右图为某种氧电化学传感器的 原理示意图。已知在测定O2含量过程 中,电解质溶液的质量保持不变。一定时 间内,若通过传感器的待测气体为aL(标 准状况),某电极增重了b g。下列说法正确的是
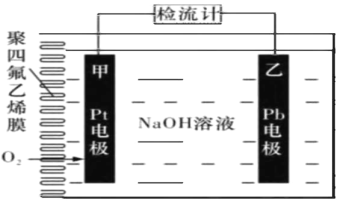
A.Pt电极为负极
B.反应过程中转移OH-的物质的量为0.125bmol
C.Pb电极上发生的电极反应为Pb-2e- +2OH- = Pb(OH)2
D.待测气体屮氧气的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
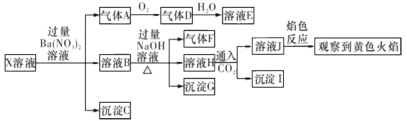
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:2X(g) + Y(g) ![]() 3Z(g),Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
3Z(g),Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
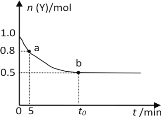
A.t0 min时,n(Z)=0.75 mol
B.0~5min内,以X表示的化学反应速率是0.02 mol·L-1·min-1
C.正反应速率a点比b点大
D.b点时该反应达到了最大限度,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年北京市公交行业迈入氢能源时代。“制氢”“储氢”“用氢”等一直都是能源研究的热点。工业上制取H2有多种方法.如:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1
④2H2O(g)=2H2(g)+O2(g) △H4=+483.6kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____________________ .
(2)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的_______倍(计算结果保留两位有效数字)。
(3)科学家研发的“全氢电池"的工作原理如图所示,该电池工作一段时间后,右池溶液的导电 能力几乎不变。下列有关该电 池的说法正确的是 _____(填字母代号)。

a.电池的总反应是2H2 +O2 = 2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2 - 2e- + 2OH- = 2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
(4)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是Li1-xFePO4+LixC6![]() LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .
LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物1,,3,5,7-辛四烯可用于制合成纤维、染料、药物等,其结构 简式为![]() 。该物质的合成方法如下图所示:
。该物质的合成方法如下图所示:
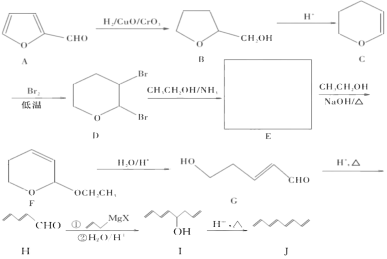
(1)1,3,5,7-辛四烯的分子式为______,有机物A所含含氧官能团有 _______(填名称)。
(2)E的结构简式为______.
(3)I→J的反应类型为______.
(4)![]() 在一定条件下可以发生加聚反应,合成无支链的链状有机高分子。写出该反应的化学方程式: ________________________ .
在一定条件下可以发生加聚反应,合成无支链的链状有机高分子。写出该反应的化学方程式: ________________________ .
(5)符合条件的G的同分异构体有___________种。
①与碳酸氢钠溶液反应产生气体 ②不能使溴水褪色
(6)以CH3CHO 、 HCHO和![]() 为原料也可以合成1,3,5,7-辛四烯,试写出合成路线。(其他试剂任选)_____________________________________________________________________ .已知:
为原料也可以合成1,3,5,7-辛四烯,试写出合成路线。(其他试剂任选)_____________________________________________________________________ .已知:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.25℃,1 LpH=13的NaOH溶液中含有OH-的数目为0.1NA
B.标准状况下,4.6 g NO2和N2O4混合物中含氧原子数为0.3NA
C.标准状况下,6.72 L Cl2与水充分反应,转移电子数为0.3NA
D.0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率___(填“增大”“减小”或“不变”)。
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,反应前15min用SO3表示的平均反应速率为___。
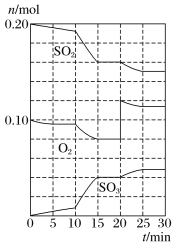
(3)已知0-15min反应放出的总热量为QkJ,写出该反应的热化学方程式____。
(4)根据如图判断,10min时改变的反应条件可能是___(填编号,下同);20min时改变的反应条件可能是____。
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O2的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com