
【题目】下列说法正确的是
A.氯水能导电,所以氯气是电解质
B.碳酸钙难溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于电解质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_________________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
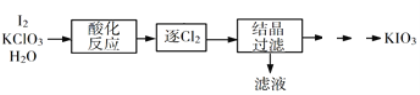
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是______________________。
“滤液”中的溶质主要是__________________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
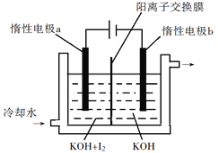
①写出电解时阴极的电极反应式________________________________。
②电解过程中通过阳离子交换膜的离子主要为_______________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有___________________________________________(写出一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
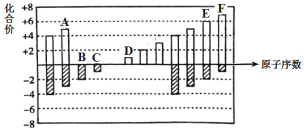
(1)元素F在周期表中的位置是 ______。
(2)元素C、D、E原子半径由大到小的顺序是 ______(填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____(用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______、__(写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 _____(填“能”或“不能”), 若能则写出反应的化学方程式 ______。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ![]() 2AB2(g)。可以作为达到平衡状态的标志是 ______。
2AB2(g)。可以作为达到平衡状态的标志是 ______。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 新制饱和氯水中:A13+、Cu2+、SO42-、Br-
B. 甲基橙变红的溶液:Mg2+、Fe2+、NO3-、SCN-
C. 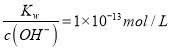 的溶液中:Na+、K+、Cl-、AlO2-
的溶液中:Na+、K+、Cl-、AlO2-
D. 水电离的c(H+)=1×10-13mol/L的溶液中:Ca2+、Ba2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于对各有机物的说法正确的是
A.苯分子中的所有原子均在同一平面上
B.甲烷能使酸性KMnO4溶液褪色
C.乙醇能使紫色石蕊试液变红
D.蛋白质只含有C、H、O三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
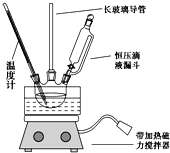
①组装如图反应装置。配制混酸,取100mL烧杯,用20mL浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知:i.![]() +HNO3(浓)
+HNO3(浓)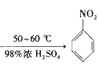 +H2O
+H2O
![]() +HNO3(浓)
+HNO3(浓)
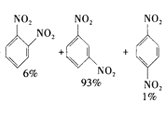 +H2O
+H2O
ii可能用到的有关数据列表如下:
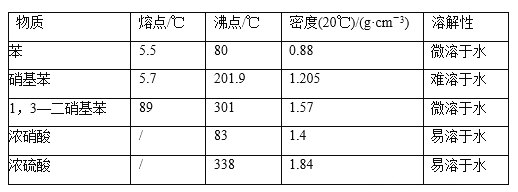
(1)配制混酸应在烧杯中先加入___________。
(2)恒压滴液漏斗的优点是_____________。
(3)实验装置中长玻璃管可用_______代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为_________。
(5)为了得到更纯净的硝基苯,还需先向液体中加入___(填化学式)除去水,然后采取的最佳实验操作是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com