
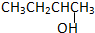 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③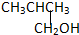 ④
④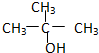
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
分析 由醇氧化为醛时,醇应为R-CH2OH,若与-OH相连的C上只有1个H被氧化为酮,若与-OH相连的C上不含H,不能发生催化氧化,以此来解答.
解答 解:醇发生催化氧化的规律是:
当连接羟基的碳上有两个氢原子时,催化氧化成醛;
当连接羟基的碳上有一个氢原子时,催化氧化成酮;
当连接羟基的碳上没有氢原子时,不能催化氧化;
根据以上规律对题中四种有机物进行判断.由结构简式可知,②③均符合R-CH2OH,可氧化为醛,而①氧化为酮,④不能被氧化,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇性质的考查,注意醇催化氧化结构上的特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
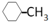 +H2
+H2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: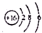 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com