
 的系统命名为2,2,3-三甲基丁烷.
的系统命名为2,2,3-三甲基丁烷. 的分子式为C4H9O2Cl.
的分子式为C4H9O2Cl.分析 (1)烷烃命名遵循长、多、近、小、简原则;
(2)1mol烃CxHy的耗氧量为(x+$\frac{\\;y}{4}$)mol,据此计算判断耗氧量,依据碳元素守恒判定后者;
(3)改有机物值含有2个羟基和一个Cl原子,据此书写分子式;
(4)根据加成反应的原理,采取倒推法还原C=C双键,从分子中减掉氯原子形成C=C双键,可得不饱和烃的结构;
(5)某有机物分子式是C3H4O2,它的水溶液显酸性,既能跟碳酸钠溶液反应,说明含有-COOH,能使溴水褪色,说明含有C=C或C≡C,据此分析;
(6)它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C形成正四面体结构;
(7)溴乙烷与氢氧化钠的醇溶液共热发生消去反应生成乙烯和溴化钠,水.
解答 解:(1) 最长碳链为4,再2号碳上含有2个甲基,在3号碳上含有1个甲基,正确命名为2,2,3-三甲基丁烷,故答案为:2,2,3-三甲基丁烷;
最长碳链为4,再2号碳上含有2个甲基,在3号碳上含有1个甲基,正确命名为2,2,3-三甲基丁烷,故答案为:2,2,3-三甲基丁烷;
(2)1mol烃CxHy的耗氧量为(x+$\frac{\\;y}{4}$)mol,分子中C原子数目相等,故H原子数目越大,消耗氧气越多,故C2H6的耗氧量最大;
各烃分子中含有C原子数目相等,烃的物质的量相等,根据碳原子守恒可知,各烃生成二氧化碳的质量相等,故答案为:C2H6;CO2;
(3) 的分子式为C4H9O2Cl,故答案为:C4H9O2Cl;
的分子式为C4H9O2Cl,故答案为:C4H9O2Cl;
(4)根据加成反应的原理,采取倒推法还原C=C双键,从分子中减掉氯原子形成C=C双键,可得不饱和烃的结构为(CH3)2C=CH-CH2-CH3,故答案为:(CH3)2C=CH-CH2-CH3;
(5)有机物A的分子式为C3H4O2,它的水溶液显酸性,既能跟碳酸钠溶液反应,说明含有1个-COOH,其不饱和度=$\frac{3×2+2-4}{2}$=2,说明分子中除了羧基还有1个不饱和键,能使溴水褪色,则分子中含有1个C=C双键,所以该有机物的结构简式为CH2=CHCOOH;故答案为:CH2=CHCOOH;
(6)它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C形成正四面体结构结构式为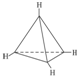 ,故答案为:正四面体;
,故答案为:正四面体;
(7)溴乙烷与氢氧化钠的醇溶液共热发生消去反应生成乙烯和溴化钠,水;反应的化学方程式为:CH3CH2Br+NaOH$→_{醇}^{加热}$CH2=CH2↑+NaBr+H2O,故答案为:CH3CH2Br+NaOH$→_{醇}^{加热}$CH2=CH2↑+NaBr+H2O.
点评 本题主要考查的是有机物的命名、结构简式书写、常见有机物的性质等,综合性较强,但是难度不大.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 金属离子只能被还原,不能被氧化 | |
| D. | 金属氧化物不一定都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉露置在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| D. | 强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中苯酚,加入溴水后过滤 | |
| B. | 乙醛中含乙酸杂质,加入氢氧化钠溶液洗涤,分液 | |
| C. | 除去乙酸乙酯中乙酸,加入饱和NaOH溶液,振荡静置后分液 | |
| D. | 区别乙酸、乙醛、乙醇,加入新制的Cu(OH)2悬浊液加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可作粘合剂及耐火材料 | B. | 硅可做半导体材料 | ||
| C. | 二氧化硅是光导纤维的原料 | D. | 氮化硅陶瓷是做电子元件的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是3,4一二甲基辛烷
的名称是3,4一二甲基辛烷 ,1mol该烃完全燃烧需消耗氧气18.5mol.
,1mol该烃完全燃烧需消耗氧气18.5mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com