
【题目】电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
装置 | 实验现象 |
1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3 溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____。
(2)检验另一电极产物的操作及现象是_____。
(3)负极的电极反应式为_____。
II. 工业上用 Na2SO4 溶液吸收工业烟气中的低浓度 SO2 形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是 ____。
(5)阳极区 pH 降低的原因是____。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____。(写出一条即可)
【答案】FeCl2 取少量电解液于试管,加入足量的盐酸酸化的氯化钡溶液,若产生白色沉淀则证明有硫酸钠的生成 SO32-+H2O-2e-=SO42-+2H+ H2O 电极反应生成H+ 阴极电极反应式为SO2+4H++4e-=S+2H2O,阴极区不断消耗氢离子并生成水
【解析】
FeCl3与Na2SO3发生氧化还原反应,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;根据电解池示意图可知,生成氧气的为阳极发生氧化反应,则阴极生成S。
(1)取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,说明有亚铁离子产生,证明FeCl3转化成FeCl2。
(2)另一电极发生氧化反应生成硫酸钠,检验硫酸根离子的操作为取少量电解液于试管,加入足量的盐酸酸化的氯化钡溶液,若产生白色沉淀则证明有硫酸钠的生成。
(3)负极发生氧化反应,亚硫酸钠中硫元素化合价升高发生氧化反应生成硫酸钠,电极反应式为SO32-+H2O-2e-=SO42-+2H+。
(4)根据电解池装置示意图,生成氧气一极为阳极,阳极的pH不断降低可知反应生成H+,据此判断阳极反应为2H2O-4e-=4H++O2,电极反应物是H2O。
(5) 阳极电极反应生成H+,故阳极区 pH 降低。
(6) 阴极发生还原反应,二氧化硫与氢离子反应生成S和水,电极反应式为SO2+4H++4e-=S+2H2O,阴极区不断消耗氢离子并生成水,故pH 升高。


科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是

A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究溶液的 pH 对 KI 与 O2 反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ① 2 mL 1 mol/L KI 溶液+5 滴淀粉 | 5 分钟后无明显变化 |
② 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L HCl 溶液 | 5 分钟后溶液变蓝 | |
③ 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L KCl 溶液 | 5 分钟后无明显变化 | |
④ 2 mL pH=8.5 混有 KOH 的 1 mol/L KI 溶液+5 滴淀粉 | 5 小时后溶液才略变蓝 | |
⑤ 2 mL pH=10混有KOH的1 mol/L KI 溶液+5 滴淀粉 | 5 小时后无明显变化 |
(1)实验①中无现象,可能的原因是:i.KI与O2不反应,ii._____。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是_____。
(3)去掉实验③,对该探究过程_____(填“有”或“没有”)影响。
(4)对比实验②和实验④,可以得出的结论是_____。
(5)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化 I-”,设计了下列装置进行实验⑥,验证猜想。
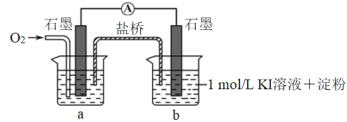
i.烧杯a 中的溶液为_____。
ii. 实验结果是b 中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是_____。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为
A.1.12L B.2.24L C.3.36L D.4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ/mol,下列说法或表示式正确的是
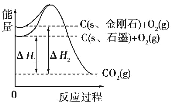
A.金刚石的稳定性强于石墨
B.石墨和金刚石的转化是物理变化
C.C(s、石墨)=C(s、金刚石) ΔH=+1.9kJ·mol-1
D.断裂1 mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
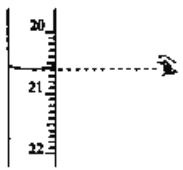
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Na2SO3固体在隔绝空气加热条件下的分解产物,设计如下实验流程:
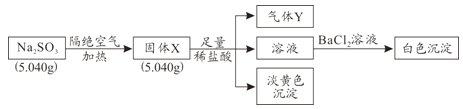
已知:气体Y是一种纯净物,在标准状况下密度为1.518g/L。
请回答下列问题:
(1)气体Y为_______。
(2)固体X与稀盐酸反应产生淡黄色沉淀的离子方程式为_______。
(3)实验过程中若测得白色沉淀的质量为6.291g,则Na2SO3的分解率为_______。
(4)Na2SO3在空气易被氧化,检验Na2SO3是否氧化变质的实验操作是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com