
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________________。
(3)实验①和②的目的是___________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
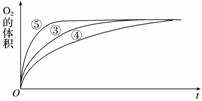
分析上图能够得出的实验结论是____________________________________________。
答案 (1)降低了反应的活化能
(2)H2O2H++HO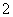
(3)探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
解析 (1)加入催化剂,能降低反应的活化能,使更多的分子成为活化分子,从而加快化学反应速率。
(2)常温下,H2O2的pH约为6,则H2O2为弱酸,其电离方程式为H2O2H++HO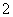 。
。
(3)实验①、②中均没有使用催化剂,只是增大了H2O2的浓度,故实验①、②的目的是探究浓度对化学反应速率的影响。因实验过程中现象不明显,可采用升温或使用同种催化剂的方法加快反应速率来达到实验目的。
(4)实验③、④、⑤中H2O2的浓度相同,并加入相同量的同种催化剂,而改变的条件是④中酸性增强,⑤中碱性增强。通过相同时间内产生O2的快慢(⑤>③>④)可得出如下结论:溶液的碱性增强,能加快H2O2的分解,而溶液的酸性增强,能减慢H2O2的分解。


科目:高中化学 来源: 题型:
根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________。
②完全沉淀后,溶液的pH=__________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?____________(填“是”或“否”)。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现代科技的高度快速发展离不开C和Si元素。
(1)写出Si的基态原子核外电子排布式__________________。
(2)从电负性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为______。
(3)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_____,微粒间存在的作用力是_______。
(4)C、Si为同一主族的元素,CO2 、SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
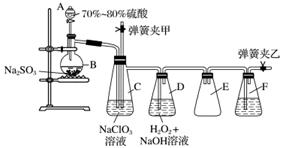
装置C中发生反应:2NaClO3+SO2===2ClO2+Na2SO4(Ⅰ)
装置D中发生反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2(Ⅱ)
(1)仪器组装完毕,关闭两个弹簧夹,打开A中活塞,向A中注入水可检验装置气密性,装置气密性良好的现象是________________________。实验开始时,打开A的活塞,两个弹簧夹的开关操作是__________________,F中盛有的液体为________。
(2)装置B中进行的是用硫酸与亚硫酸钠制备二氧化硫的反应,该处使用的是70%~80%的硫酸,而不是98%的浓硫酸或极稀的硫酸,原因是___________________________________。
(3)装置C的作用是________________,装置E的作用是________________。
(4)在碱性溶液中NaClO2比较稳定,所以装置D中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是________。
a.稀盐酸 b.品红溶液 c.石蕊溶液 d.酚酞溶液
(5)一次实验制备中,通过检验发现制备的NaClO2中含有NaOH、Na2SO3,出现这些杂质的可能原因是__________________。检验产物中含有Na2SO3杂质的实验操作和现象是________________________________________________________________________。
(供选择的试剂有:Ba(OH)2溶液、H2O2溶液、AgNO3溶液、品红溶液、H2SO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空
(1)形状大小相同的铁、铝分别与等浓度的盐酸反应生成氢气的速率:铁______铝(填“大于”、“小于”或“等于”)。
(2)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不变”)
①升高温度:________;
②增大盐酸浓度:__________;
③增大铁的质量:__________;
④增加盐酸体积:____________;
⑤把铁片改成铁粉:____________;
⑥滴入几滴CuSO4溶液:____________;
⑦加入NaCl固体:____________;
⑧加入CH3COONa固体____________;
⑨加入一定体积的Na2SO4溶液____________。
(3)若把(2)中的稀盐酸改成“稀硝酸”或“浓硫酸”是否还产生H2,为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
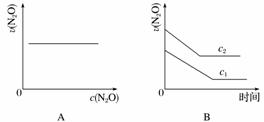
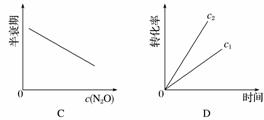
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ/mol
7molH2与C3H8混合物完全燃烧,共放热5869kJ,则二者的体积比V(H2):V(C3H8)为
A.1:1 B.2:5 C.3:4 D.5:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com