
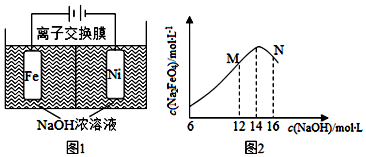
分析 (1)根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少;
(2)氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
(3)根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低.
解答 解:(1)根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH-)降低的区域在阳极室,
故答案为:阳极室;
(2)氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,
故答案为:防止Na2FeO4与H2反应使产率降低;
(3)根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,
故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低).
点评 本题考查电解池原理,明确各个电极上发生的反应是解本题关键,注意阳极发生的反应,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出| 锥形瓶中的液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| ① | 碱 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 碱 | 酚酞 | (甲) |
| ③ | 碱 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 碱 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com