
| A. | 逆反应速率增大,平衡逆向移动 | |
| B. | 正反应速率增大,平衡正向移动 | |
| C. | 正、逆反应速率都减小,平衡逆向移动 | |
| D. | 正、逆反应速率都增大,平衡正向移动 |
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | H2CO3?2H++CO32 | ||
| C. | NaHSO4═Na++HSO4- | D. | CH3COOH?H++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和同体积同浓度的HAc和HCl,所需碱的物质的量是相同的 | |
| B. | 由H2CO3的解离平衡,可知溶液中[H+]和[CO32-]的比值=2:1 | |
| C. | 某弱酸溶液越稀,其电离度越大 | |
| D. | 强电解质溶液无离解常数,但可以有溶度积常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++SO42- | B. | NH4NO3═NH4++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA | |
| C. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA | |
| D. | 1 mol/L的盐酸溶液中含的离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
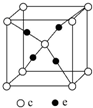 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ热量 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1molA-A键吸收akJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com