
【题目】空气中SO2含量是重要的空气质量指标.
(1)某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10﹣3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
a.取25.00ml的烟道气的水溶液所用仪器名称是
b.滴定终点标志为
c.该厂排放的烟道气中SO2的含量为mg/(L烟道气)
(2)该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
a.该白色浑浊物为 , 产生该现象的原因可能是
b.为了避免产生沉淀,该同学设计了如下实验装置,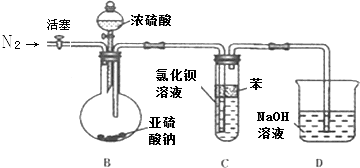
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2 , 其作用是: .
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式 .
【答案】
(1)酸式滴定管;滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色;0.512
(2)BaSO4;空气和溶液中氧气把H2SO3氧化成了H2SO4 , 从而生成BaSO4;赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;错误;Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4
【解析】解:(1)a.烟道气的水溶液呈酸性,要准确量取25.00ml可以用酸式滴定管,所以答案是:酸式滴定管;b.用碘水滴定道气的水溶液,用淀粉溶液作指示剂,滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色,所以答案是:滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色;c.根据表中的数据可知,第二组数据偏差较大,应去掉,所以反应用掉的碘的物质的量为1.0×10﹣3mol/L× ![]() ×10﹣3L=6.0×10﹣6mol,根据方程式SO2+I2+2H2O═H2SO4+2HI,可知SO2的物质的量为6.0×10﹣6mol,所以25mL溶有SO2的溶液中SO2的含量为
×10﹣3L=6.0×10﹣6mol,根据方程式SO2+I2+2H2O═H2SO4+2HI,可知SO2的物质的量为6.0×10﹣6mol,所以25mL溶有SO2的溶液中SO2的含量为 ![]() =15.36mg/L,所以排放的烟道气中SO2的含量为
=15.36mg/L,所以排放的烟道气中SO2的含量为 ![]() =0.512mg/(L烟道气)所以答案是:0.512;(2)a.二氧化硫与水反应生成亚硫酸,亚硫酸能被空气中的氧气或溶液中的氧气氧化成硫酸,能与氯化钡反应生成硫酸钡,所以白色沉淀为BaSO4 , 所以答案是:BaSO4;空气和溶液中氧气把H2SO3氧化成了H2SO4 , 从而生成BaSO4;b.①为了避免二氧化硫溶于水而被氧化产生沉淀,应将装置中的空气排尽,所以要通纯净的氮气,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响,所以答案是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;②二氧化硫的水溶液呈酸性,所以将二氧化硫通入硝酸钡溶液中,二氧化硫能被硝酸根氧化成硫酸根离子,而产生硫酸钡沉淀,所以该同学判断错误,反应的方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 , 所以答案是:错误;Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 .
=0.512mg/(L烟道气)所以答案是:0.512;(2)a.二氧化硫与水反应生成亚硫酸,亚硫酸能被空气中的氧气或溶液中的氧气氧化成硫酸,能与氯化钡反应生成硫酸钡,所以白色沉淀为BaSO4 , 所以答案是:BaSO4;空气和溶液中氧气把H2SO3氧化成了H2SO4 , 从而生成BaSO4;b.①为了避免二氧化硫溶于水而被氧化产生沉淀,应将装置中的空气排尽,所以要通纯净的氮气,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响,所以答案是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;②二氧化硫的水溶液呈酸性,所以将二氧化硫通入硝酸钡溶液中,二氧化硫能被硝酸根氧化成硫酸根离子,而产生硫酸钡沉淀,所以该同学判断错误,反应的方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 , 所以答案是:错误;Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 .


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基)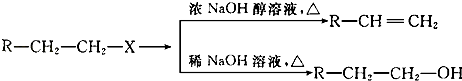
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)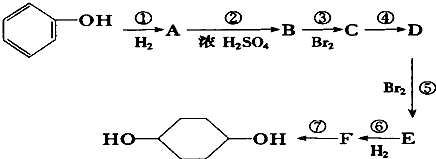
请回答下列问题:
(1)分别写出B、D的结构简式:B_、D .
(2)反应①~⑦中属于消去反应的是 . (填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mLNaOH溶液中投入10.8g Al,二者恰好完全反应后,则参加反应的NaOH的物质的量为;原NaOH溶液的物质的量浓度为;生成标准状况下H2的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时的得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是( ) 
A.该晶体为分子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
B.常温常压下,18 g H2O 中含有的原子总数为3NA
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
D.1 mol Cl2与1 mol Fe反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )![]()

A.在pH<4.76的溶液中,c(CH3COOˉ)<c(CH3COOH)
B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COOˉ)=1.0
C.在pH>4.76的溶液中,c(CH3COOˉ)与c(OHˉ)之和可大于c(H+)
D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COOˉ)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方法均可制得Fe(OH)2白色沉淀.
(1)方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.①用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
②除去蒸馏水中溶解的O2常采用的方法.
③制取Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是:防止发生反应 . (填化学方程式)
(2)方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
①在试管Ⅰ里加入的试剂是 .
②为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为 , 该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是 , 阳极电极反应为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com