
(本题共12分)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=  Q(Q>0)。
Q(Q>0)。
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
29.写出该反应的平衡常数表达式__________________________________________。
30.前2s内的平均反应速率υ(N2) = mol/(L·s);达到平衡时,CO的转化率为 。
31.下列描述中能说明上述反应已达平衡的是________________
A.2υ正(NO)=υ逆(N2)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的转化率不再发生变化
32.采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,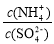 的值将 (填“变大”、“不变”或“变小”)
的值将 (填“变大”、“不变”或“变小”)
33.有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是________________(填编号);
34.向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象__________________________________________________________。
29. K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2 (1分)
30.1.875×10-4 mol/(L·s) (2分) 25% (2分)
31.B、D (2分) 32.变大 (1分) 33.②>①>③ (2分)
34.饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀。加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生。(2分)
【解析】
试题分析:29. 反应2NO(g)+2CO(g)  N2(g)+2CO2(g)的化学平衡常数是K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2;
N2(g)+2CO2(g)的化学平衡常数是K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2;
30. 在前2s内,c(NO)由1.00×10-3mol/L变为2.50×10-4mol/L,改变了7.50×10-4mol/L,则根据方程式中NO与N2的反应关系可知N2浓度是7.50×10-4mol/L÷2=3.75mol/L。则V(N2)= 3.75mol/L÷2s=1.875×10-4 mol/(L·s);达到平衡时,CO的转化率为[(3.60×10-3mol/L-2.70×10-3mol/L)÷3.60×10-3mol/L]×100%=25%;
31. A.在任何时刻都存在:υ正(NO)= 2υ正(N2) 。若2υ正(NO)=υ逆(N2),则υ逆(N2)=4υ正(N2) ,用同一种物质表示的化学反应速率,正逆反应速率不等,反应没有处于平衡状态,错误; B.由于该反应是反应前后气体体积不等的质量不变的反应,若反应达到平衡状态,则气体的物质的量不变,容器中气体的平均分子量就不变,因此容器中气体的平均分子量应不随时间而变可以证明反应处于平衡状态,正确;C.由于该反应反应物和生成物都是气体,容器的容积不变,所以在任何时刻容器中气体的密度都不会发生变化,因此不能作为判断平衡的标志,错误; D.若容器中CO的物质的量发生变化,反应就没有达到平衡状态,若达到平衡状态,则CO的物质的量不变,CO的转化率不变,反应处于平衡状态,正确;
32.往(NH4)2SO4的稀溶液中再加入少量 (NH4)2SO4固体,溶液的浓度增大。由于该盐是强酸弱碱盐,NH4+会发生水解反应而消耗,浓度增大,盐的水解平衡逆向移动,盐水解的程度减小, 的值将变大。
的值将变大。
33.在三种盐溶液中都存在NH4+的水解作用,NH4++H2O NH3·H2O+H+;NH4+水解使溶液显酸性,在NH4HCO3溶液中除了存在NH4+水解外,还存在HCO3-的水解作用:HCO3-+H2O
NH3·H2O+H+;NH4+水解使溶液显酸性,在NH4HCO3溶液中除了存在NH4+水解外,还存在HCO3-的水解作用:HCO3-+H2O H2CO3+OH-;HCO3-水解使溶液显碱性,二者的水解的酸碱性相反,对彼此的水解起促进作用,所以水解程度增大。对于NH4HSO4来说,是强酸的酸式盐,NH4HSO4=NH4++H++SO42-。电离产生的H+对NH4+的水解平衡起抑制作用,是其水解程度减小。所以① NH4Cl、②NH4HCO3、③NH4HSO4这三种溶液中水的电离程度由大到小的顺序是②>①>③;
H2CO3+OH-;HCO3-水解使溶液显碱性,二者的水解的酸碱性相反,对彼此的水解起促进作用,所以水解程度增大。对于NH4HSO4来说,是强酸的酸式盐,NH4HSO4=NH4++H++SO42-。电离产生的H+对NH4+的水解平衡起抑制作用,是其水解程度减小。所以① NH4Cl、②NH4HCO3、③NH4HSO4这三种溶液中水的电离程度由大到小的顺序是②>①>③;
34.由于酸性HCl>H2SO3,所以向BaCl2溶液中通入足量SO2气体,只发生化合反应:SO2+H2O= H2SO3,H2SO3是弱酸,电离产生的SO32-浓度很小,没有发生复分解反应生成沉淀生成,继续滴加一定量的氨水后,氨水电离产生的OH-对H2SO3的电离平衡起促进作用,产生更多的SO32-,使c(SO32-)增大,SO32-就与溶液中的Ba2+结合生成BaSO3沉淀。
考点:考查化学平衡常数的表达式的书写、化学平衡状态的判断、盐的水解程度的大小比较及影响因素、程度平衡理论的应用、化学反应速率和物质的平衡转化率的计算的知识。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
欲证明一瓶无色液体是纯水,可靠的实验方法是
A.测得其pH=7 B.电解时得到H2与O2的体积比为2:1
C.遇钠生成氢气 D.1.01× 105Pa时沸点为100℃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
常温下有五种溶液:①NaHCO3 ;②KNO3;③ NH4HCO3;④ KOH;⑤ HCl
28.上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
上述①的水溶液呈碱性的原因是(用离子方程式表示) 。
29.取10mL 0.5mol/L⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.  ③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
30.②和④混合后撒入铝粉,有气体产生,该气体能使湿润的红色石蕊试纸变蓝。
写出该反应化学方程式:_______________________________________________________。
31.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。 A.一定向正反应方向移动
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。 A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
32.如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化
B.通入大量稀有气体能提高反应的速率
C.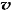 (N2)/
(N2)/  (O2)=2:3
(O2)=2:3
D.容器中气体的密度不随时间而变化
33.若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡已经发生移动的是
A.反应混合物的浓度 B.反应物的转化率
C.正、逆反应速率 D.反应混合物的压强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:计算题
(本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
将0.2 mol/L的醋酸钠溶液与0.1 mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Cl-)>c (Ac-)>c (HAc)>c (H+)
B.c (Ac-)+ c (HAc)= 0.1mol/L
C.c (Na+) >c (H+)>c (Ac-)>c (OH-)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为W(s) + 2I2(g) WI4(g)。下列说法正确的是
WI4(g)。下列说法正确的是
A.温度越高,灯丝的使用寿命越长
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下:
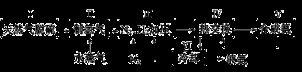
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)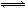 CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g)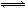 CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:填空题
(8分)近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I CaSO4(s)+ CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
II CaO(s) +3CO(g)+SO2(g) CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应1/2CaSO4(s)+2CO(g) 1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
t/s | 0 | 10 | 20 | 30 | 50 |
c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
前20 s 内v(SO2)=__________mo1·L-l·s-l,平衡时CO的转化率为__________。
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应IICaO(s) +3CO(g) +SO2 (g) CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):

①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是_______________。
②图像中T2_____T1(填“高于”、“低于”、“等于”或 “无法确定”)判断的理由是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com