
【题目】下列说法正确的是
A.水是弱电解质,电离方程式为H2O+H2O![]() H3O++OH-
H3O++OH-
B.常温下,向水中加入H2SO4溶液,H+ 浓度增大,Kw增大
C.将纯水加热到100℃,pH≈6,显酸性
D.常温下,将0.1mol·L-1的 NaOH溶液体积稀释到原来的10倍,则pH=12
【答案】AD
【解析】
A. 水是弱电解质,电离方程式为H2O+H2O![]() H3O++OH-,故A正确;
H3O++OH-,故A正确;
B. 常温下,硫酸是强电解质,在水中完全电离产生氢离子,向水中加入H2SO4溶液,H+ 浓度增大,但溶液温度不变,则Kw不变,故B错误;
C. 将纯水加热到100℃,,pH≈6,加热促进水的电离,氢离子和氢氧根离子浓度都增大,且氢离子浓度等于氢氧根离子浓度,显中性,故C错误;
D. 氢氧化钠为强碱,常温下,0.1mol·L-1的 NaOH溶液氢氧根离子浓度为0.1 mol·L-1,将体积稀释到原来的10倍,氢氧根离子的浓度变为原来的十分之一,即氢氧根离子浓度为0.01 mol·L-1,则此时pOH=2,因此pH=14-pOH=14-2=12,故D正确;
答案选AD。


科目:高中化学 来源: 题型:
【题目】某温度时,在体积为2L的密闭容器中,气态物质A、B、E、F的物质的量n随时间t的变化情况如图甲所示,在一定条件下反应达到平衡状态,反应进程中正反应速率随时间的变化情况如图乙所示,在![]() 、
、![]() 时刻分别只改变一个条件
时刻分别只改变一个条件![]() 温度、压强或某反应物的量
温度、压强或某反应物的量![]() 。下列说法错误的是
。下列说法错误的是

A.此温度下,该反应的化学方程式为![]()
B.若平衡状态![]() 和
和![]() 对应的温度相同,则
对应的温度相同,则![]() 和
和![]() 对应的平衡常数K一定相同
对应的平衡常数K一定相同
C.![]() 时刻改变的条件是增大压强
时刻改变的条件是增大压强
D.![]() 时刻改变的条件是降低温度
时刻改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为2L的恒容密闭容器中,充入8 mol A和4 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(s)+D(g),2 min达平衡,测得生成3.2mol C,下列说法正确的是
4C(s)+D(g),2 min达平衡,测得生成3.2mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.4 mol·L-1·min-1
B.B的平衡转化率是40%
C.其他条件不变,增大该体系的压强,平衡不移动
D.其他条件不变,向平衡体系中充入B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R’CH2Cl![]() RNHCH2R’+HCl(R和R’代表烃基)
RNHCH2R’+HCl(R和R’代表烃基)
②苯的同系物能被高锰酸钾氧化,如:![]()
![]()
![]()
③![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:

请回答下列问题:
(1)B物质的结构简式是 ______。
(2)写出反应①、②的化学方程式:
①______________;
②______________。
(3)反应①~⑤中,属于取代反应的是______(填反应序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D 的原子序数依次增大,A、B、C 原子的最外层电子数之和为 12,B、C、D 位于同一周期,C 原子的最外层电子数既是 A 原子内层电子数的 3 倍又是 B 原子最外层电子数的 3 倍。下列说法正确的是( )
A.元素 A、C 的最高价氧化物对应的水化物的酸性:A>C
B.元素B 能与 A 的最高价氧化物发生置换反应
C.AC2 空间构型为角形
D.C2D2 是共价化合物,且为直线型非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
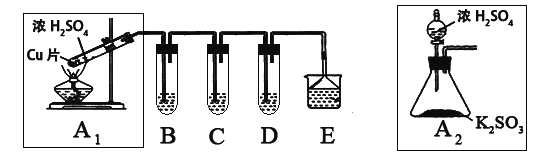
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
步骤3____________________________________________ | _________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对H2O2的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下出O2浓度随时间变化如图所示。下列说法不正确的是( )
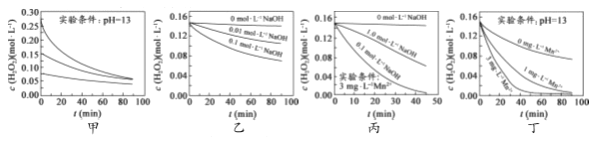
A. 图甲表明,可通过适当增大H2O2浓度,加快H2O2分解速率
B. 图乙表明,可通过调节溶液的酸碱性,控制H2O2分解速率快慢
C. 图丙表明,Mn2+少量存在时,碱性太强,不利于H2O2分解
D. 图乙、图丙和图丁表明,Mn2+是H2O2分解的催化剂,提高Mn2+的浓度就能增大H2O2 分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是

A.X是负极,Y是正极
B.CuSO4溶液的pH减小
C.a极产生的气体能使湿润的红色石蕊试纸先变红后褪色
D.若电路中转移了0.02 mol e-,Fe电极增重0.64g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com