
【题目】诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工高温业上冶炼钼的化学反应过程为①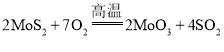 ;②
;②![]() ;③
;③![]() ;④
;④ ;⑤用还原剂将
;⑤用还原剂将![]() 还原成金属钼。下列说法正确的是( )
还原成金属钼。下列说法正确的是( )
A.![]() 煅烧产生的尾气可直接排放
煅烧产生的尾气可直接排放
B.![]() 是金属氧化物,也是碱性氧化物
是金属氧化物,也是碱性氧化物
C.![]() 是一种强酸
是一种强酸
D.利用![]() 、
、![]() 和
和![]() 分别还原等量的
分别还原等量的![]() ,所消耗还原剂的物质的量之比为
,所消耗还原剂的物质的量之比为![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A.淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型钙钛矿型太阳能电池以其稳定、高效、便宜和便于制造等优点被科学家所青睐。这种钙钛矿型太阳能电池材料为层状结构。具体如图1所示。
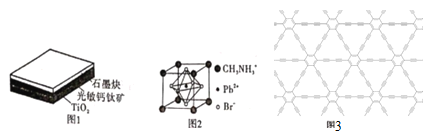
(1)基态Ti原子的电子排布式为____;同周期的基态原子与其未成对电子数相同的元素还有________种。
(2)光敏钙钛矿的晶胞结构如图2所示。
①写出与CH3NH3+互为等电子体的一种分子的化学式:__,C、N、O三种元素的第一电离能由大到小的顺序为____(用元素符号表示),CH3NH3+中含有的化学键类型有____。
②光敏钙钛矿的化学式为________;每个CH3NH3+周围最近且等距离的Br-数目为__。
③若该光敏钙钛矿的摩尔质量为M g·mol-1,晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g.cm-3(用含M、a、NA的代数式表示)。
(3)石墨炔的结构如图3所示,其中碳原子的轨道杂化类型是 _____ ,36 g石墨炔中含有σ键的数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成,并以液态储存。
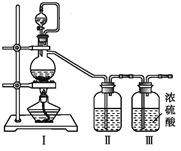
(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:_______
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
实验项目 | 装置Ⅰ | 装置Ⅱ | |
制备的气体 | 烧瓶中 | 分液漏斗中 | |
a .制备纯净干燥的Cl2 | MnO2 | _______ | _______ |
b .制备纯净干燥的NO | Cu | _______ | _______ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
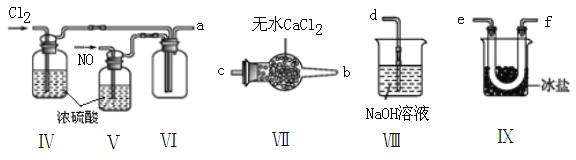
①装置连接顺序为a→____________________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________________。
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_________________________。
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )
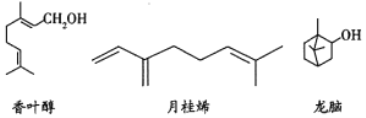
A. 香叶醇和龙脑互为同分异构体,分子式均为![]()
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A.沸点:正丁烷>2-甲基丁烷
B.密度:CCl4>苯
C.等质量的物质燃烧耗O2量:乙烷>甲烷
D.等物质的量物质燃烧耗O2量:乙醇>乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:

(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则 K3=________(用含 K1、K2 的代数式表示)。
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a______0(选填“>”或“<”)。
②下列说法正确的是______(填字母序号)。
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为________(保留三位有效数字)。
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2 ,则n(H2)/n(C2H4)将____(填“变大”、“不变”或“变小”)。
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为_______。
⑥该装置中使用的是__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com