
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
分析 A.二氧化硫过量,反应生成亚硫酸氢钠;
B.最外层为2个电子的可能为ⅡA族或者是氦;
C.B原子不满足8电子结构;
D.二氧化硫具有漂白性,且其漂白性具有不稳定性;
解答 解:A.过量SO2通入NaOH溶液中发生SO2+OH-═HSO3-反应,故A错误;
B.BF3分子中B原子最外层电子数为3+3=6,不满足8电子结构,故B错误;
C.某元素原子的最外层只有2个电子,则该元素可能是ⅡA族元素或者氦,故C错误;
D.二氧化硫具有漂白性,且其漂白性具有不稳定性,使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉物质的性质及结构是解题关键,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 | |
| B. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常使用电解精炼法将粗铜提纯,在电解精练时,阳极减少的质量等于阴极增加的质量 | |
| B. | 心脏起搏器中使用的新型Li-I2 电池的寿命已超过10年,其反应可简单表示为2Li+I2═2LiI,阴极反应为:2Li-2e-═2Li+ | |
| C. | 为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌 | |
| D. | 某物质的溶解度为难溶,则该物质不溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1的醋酸钠溶液中,c2(H+)=Kw-c(CH3COOH)•c(H+) | |
| B. | 常温下,各为0.1mol•L-1的NaHCO3和Na2CO3的混合溶液中:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 向氨水中滴加适量的盐酸呈酸性时,不可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-) | |
| D. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
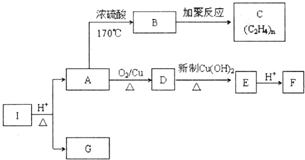 化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如图.根据以上信息回答下列问题.
化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如图.根据以上信息回答下列问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液颜色会加深 | |
| D. | 配制碘水时,加入KI可增大I2的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com