


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
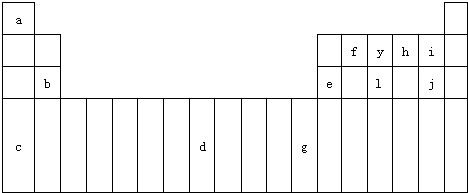
 如图为元素周期表的一部分.表中所列的字母分别代表某一元素.
如图为元素周期表的一部分.表中所列的字母分别代表某一元素.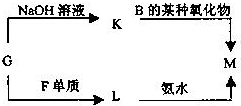
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 | ⅠA | 0 | ||||||
| 周期 | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
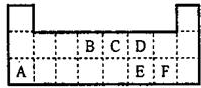
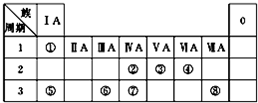 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| Ⅰ | 酸性 | |
| Ⅱ | 还原性 |
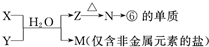
查看答案和解析>>
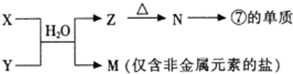
科目:高中化学 来源:2012届湖北省高二上学期期末统考化学试卷 题型:选择题
如图为元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的7/8。则下列说法中正确的是:
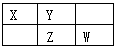
A. Y单质可与Z的氢化物的水溶液反应,使溶液pH减小
B. 最高价氧化物的水化物酸性:W>Z
C. 原子半径由大到小的排列顺序是:Z>Y>X
D. X的单质中有一种为白色蜡状固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com