
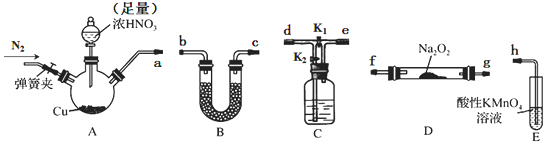
| 步骤 | 操作及现象 |
| ① | 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色. |
| ② | 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间. |
| ③ | 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同. |
分析 制备NaNO2,A装置由铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+4NO2↑+2H2O,制备NO2,由NO2与水反应3NO2+H2O=2HNO3+NO,为反应充分,关闭K1,打开K2,制备NO与过氧化钠在D中反应生成亚硝酸钠,NO不能直接排放到空气中,用酸性高锰酸钾吸收:3MnO4-+4H++5NO=3Mn2++5NO3-+2H2O,据此分析;
探究NO2或NO可能与溶液中Fe2+发生反应:选择上述装置并按A→C→E顺序连接,E中装入FeSO4溶液:①关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色,说明NO2或NO与溶液中Fe2+发生反应;②停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间,将装置中残留的二氧化氮排尽,并在C中与水反应,3NO2+H2O=2HNO3+NO;③更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同,经过步骤②,进入E装置的气体为NO,E中溶液变为深棕色,说明是NO与和溶液中Fe2+发生反应使溶液呈深棕色.
解答 解:(1)装置A三颈烧瓶中铜与浓硝酸发生反应之被逼二氧化氮,化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+4NO2↑+2H2O;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+4NO2↑+2H2O;
(2)制备NaNO2,A装置制备NO2,由NO2与水反应制备NO,为反应充分,关闭K1,打开K2,则a连接d,过氧化钠与水反应,故NO先干燥再与过氧化钠反应,e连接U形干燥管b,与过氧化钠在D中反应生成亚硝酸钠,c连接f,NO不能直接排放到空气中,用酸性高锰酸钾吸收,g连接h;
故答案为:debcfg(b与c、f与g可以交换);关闭K1,打开K2;
(3)E装置为酸性高锰酸钾与NO的反应,NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+,离子方程式为:3MnO4-+4H++5NO=3Mn2++5NO3-+2H2O;
故答案为:3MnO4-+4H++5NO=3Mn2++5NO3-+2H2O;
(4)①关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色,说明NO2或NO与溶液中Fe2+发生反应;②停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间,将装置中残留的二氧化氮排尽,并在C中与水反应,3NO2+H2O=2HNO3+NO;③更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同,经过步骤②,进入E装置的气体为NO,E中溶液变为深棕色,说明是NO与和溶液中Fe2+发生反应使溶液呈深棕色;
故答案为:排尽装置中残留的NO2;3NO2+H2O=2HNO3+NO;NO.
点评 本题考查了物质制备方案设计和物质性质探究,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10中只有3种属于芳香烃的同分异构体 | |
| B. | 苯与溴水混合振荡,水层颜色变浅 | |
| C. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| D. | 油脂、蛋白质、纤维素均属于高分子化合物,可以发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y | Z |
| A. | 氢化物的稳定性:N>Z,是因为其氢化物分子可形成氢键 | |
| B. | 元素的非金属性:M>Y,是因为单质M能与YN2反应生成单质Y | |
| C. | 熔沸点:YN2>MN2,是因为YN2的分子间作用力强 | |
| D. | 简单离子的半径:N>X,是因为它们具有相同的电子层结构且X的核电荷数更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放碱液的试剂瓶不用玻璃塞;SiO2+2OH-═SiO32-+H2O | |
| B. | 配制FeCl3溶液时要加盐酸:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 制Cl2时用排饱和氯化钠溶液收集气体:H2O+Cl2?Cl-+H++HClO | |
| D. | 金属钠燃烧时,火焰呈黄色:2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯加入溴水中振荡后,水层接近无色,是因为发生了取代反应 | |
| B. | 一体积某气态烃与HC1充分加成消耗HC1一体积,加成后的物质最多还能和5体积氯气发生取代反应,由此推断原气态烃是乙烯 | |
| C. | 环己醇能与氢氧化钠溶液反应且所有碳原子可以共面 | |
| D. | 等质量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
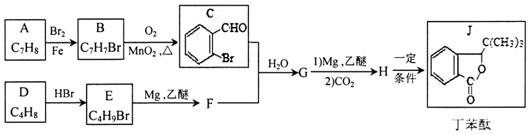
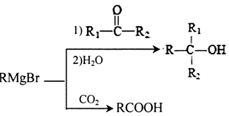
 .H发生缩聚反应生成的高分子化合物的结构简式为
.H发生缩聚反应生成的高分子化合物的结构简式为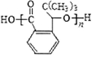 .
.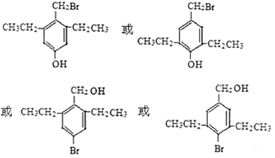 .
.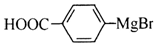 能与CO2反应生成有机物M.符合下列条件的M的同分异构体共有10种.
能与CO2反应生成有机物M.符合下列条件的M的同分异构体共有10种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
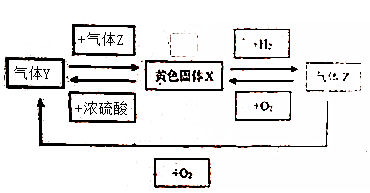
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com