
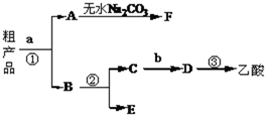
 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:

 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
| O2 |
| 800℃ |
| O2 |
| △① |
| Cu2S |
| △② |
查看答案和解析>>
科目:高中化学 来源: 题型:

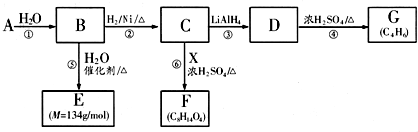
| LiAIH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝土矿溶于NaOH溶液中 |
| B、NaAlO2溶液的酸化 |
| C、灼烧氢氧化铝固体 |
| D、电解熔融的氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
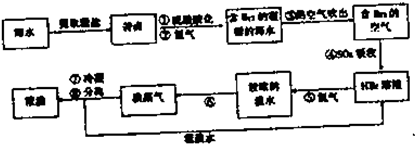
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加氨水至过量 |
| B、向Ba(NO3)2溶液通入SO2至过量 |
| C、向Ba(0H)2溶液通入CO2至过量 |
| D、向新制Fe(OH)3胶体中滴加稀硫酸至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com