
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是__________________(用离子反应方程式表示)。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是____________。
(3)在1 mol·L-1的KAl(SO4)2溶液中离子浓度由大到小的顺序是____________。
(4)某小组同学用下图所示装置探究NaClO和KAl(SO4)2饱和溶液混合反应的实验。
①打开活塞向烧瓶中加入饱和KAl(SO 4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_____________________________________________________。
4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_____________________________________________________。
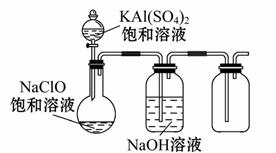
②将烧瓶中的混合液在阳光下照射,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带火星的木条复燃。写出在光照下混合液中反应的化学方程式______________________________________________________________。
(1)NaClO是一种弱酸强碱盐,其溶于水会发生水解反应而使溶液显碱性;
(2)NaClO具有漂白性,可以将纸张中的色素氧化;
(3)KAl(SO4)2溶液中Al3+ 会发生微弱的水解,而使溶液显酸性;
会发生微弱的水解,而使溶液显酸性;
(4)NaClO溶液和KAl(SO4)2溶液的酸碱性正好相反,它们混合时会发生水解相互促进反应生成HClO和Al(OH)3沉淀。所得到的溶液中含有HClO,黄绿色气体是氯气,能使 带火星的木条复燃的气体是氧气,所以HClO在光照时分解生成氯气、氧气和水,由此可以写出反应的化学方程式。
带火星的木条复燃的气体是氧气,所以HClO在光照时分解生成氯气、氧气和水,由此可以写出反应的化学方程式。
答案:(1)ClO-+H2O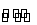 HClO+OH-
HClO+OH-
(2)漂白纸浆
(3)[SO42-]>[K+]>[Al3+]>[H+]>[OH-]
(4)①Al3++3ClO-+3H2O====3HClO+Al(OH)3↓
②4HClO 2Cl2↑+O2↑
2Cl2↑+O2↑ +2H2O
+2H2O


科目:高中化学 来源: 题型:
下列实验操作、现象和解释都正确的是(双选)( )
| 选项 | 实验操作 | 现象 | 解释 |
| A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO |
| B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生成 | 铜离子可以氧化碘离子,白色沉淀可能成为CuI |
| D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.丙烯的结构简式为CH2CHCH3
B.新戊烷的一氯代物有2种
C.分子式为CH4O和C2H6O的物质一定互为同系物
D.键线式为 的有机物的分子式为C8H8
的有机物的分子式为C8H8
查看答案和解析>>
科目:高中化学 来源: 题型:
把足量NaOH固体放入一定量的蒸馏水中,有NaOH(s) 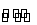 Na+(aq)+OH-(aq),一定温度下达到平衡。当向悬浊液中加少量过氧化钠后,若温度保持不变,下列判断正确的是( )
Na+(aq)+OH-(aq),一定温度下达到平衡。当向悬浊液中加少量过氧化钠后,若温度保持不变,下列判断正确的是( )
A.溶液中Na+数目增多
B.溶液中[Na+]增大
C.溶液pH不变
D.溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.01 mol·L-1的NaHCO3溶液中,下列表述正确的是
( )
A.溶液显酸性,HCO3-电离程度大于水解程度
B.[Na+]+[H+]=[HCO3-]+[CO32-]+[OH-]
C.[Na+]=[HCO3-]+[CO32-]+[H2CO3]
D.溶液中的电离过程只有NaHCO3====Na++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的下列溶液:①Na2CO3,②NaHCO3,③H2CO3,④(NH4)2CO3,⑤NH4HCO3,[CO32-]由小到大排列的顺序是( )
A.⑤<④<③<②<①
B.③<⑤<②<④<①
C.③<②<⑤<④<①
D .③<⑤<④<②<①
.③<⑤<④<②<①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.某基态原子错误的核外电子排布图为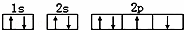 该排布图违背了泡利原理
该排布图违背了泡利原理
查看答案和解析>>
科目:高中化学 来源: 题型:
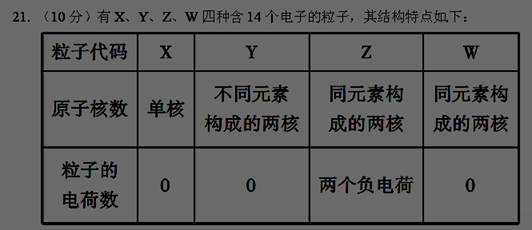
(1) A原子核外比X原子多3个电子,A的原子结构示意图是________;含1 mol X的氧化物晶体中含有共价键数目为________。
(2) Z与钙离子组成的化合物的电子式为________________。
(3) 14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式:______________________________。
(4) 组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略):

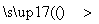

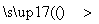

① 写出丁在高温下与水反应的化学方程式:__________________;
② 组成W的元素的简单氢化物极易溶于水的主要原因是__________________________,
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列常见实验的现象或表述正确的是( )。
A.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
B.为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.将(NH4)2Fe(SO4)2·6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com