
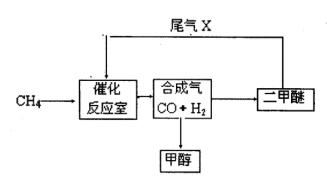
 (2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。 反应Ⅰ: CO(g)+2H2(g) CH3OH(g)
反应Ⅰ: CO(g)+2H2(g) CH3OH(g) 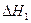
 反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
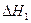 0(填“>”、“=”、“<”)。
0(填“>”、“=”、“<”)。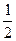 O2(g)
O2(g)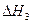 =-192.9kJ·mol-1
=-192.9kJ·mol-1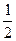 O2(g)
O2(g)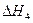 =-241.8kJ·mol-1
=-241.8kJ·mol-1 = 。
= 。 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源:不详 题型:填空题
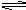 H++HSO4- HSO4-
H++HSO4- HSO4-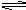 H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
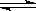 4C+6D。达到平衡时,测得A的转化率大于B的转化率。则n的取值范围正确的是
4C+6D。达到平衡时,测得A的转化率大于B的转化率。则n的取值范围正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
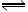 2SO3(气);△H<0,当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是: ( )
2SO3(气);△H<0,当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是: ( )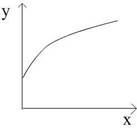
| A.x为压强,y为SO2的浓度; |
| B.x为温度,混合气体平均相对分子质量; |
| C.x为加入SO2的量,y为O2的转化率; |
| D.x为改变容器的体积,y为SO3的百分含量; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)
C(g)+D(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
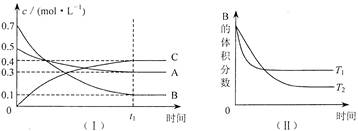
 2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g)一定达平衡状态的是 ( )
CO(g)+H2(g)一定达平衡状态的是 ( )| A.气体的压强不变 |
| B.气体的体积不变 |
| C.混合气的密度不变 |
| D.有n个H—O键断裂的同时有n个H—H键断裂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )。
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )。| A.3mol H2和1mol N2 | B.4mol NH3 |
| C.2mol N2和6mol H2 | D.2mol NH3、1mol N2、3mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com