
【题目】物质A~K有如下的转化关系,其中D、E为气体单质,试回答(图中有些反应的产物和反应的条件没有全部标出): 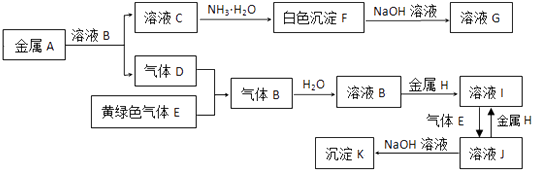
(1)写出下列物质的化学式:D是 , G是;
(2)写出“C→F”反应的离子方程式;
(3)写出反应“F→G”的离子方程式;
(4)写出反应“I→J”的离子方程式;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是;写出相关的化学反应方程式 .
(6)向200mL 3mol/L溶液J中加入60g铁、铜混合物(铁和铜的物质的量比为1:1),充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体的质量为 .
【答案】
(1)H2;NaAlO2
(2)Al3++3NH3H2O=Al(OH)3↓+3NH4+
(3)Al(OH)3+OH﹣=AlO2﹣+2H2O
(4)2Fe2++Cl2═2Fe3++2Cl﹣
(5)产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3
(6)72g
【解析】解:E为黄绿色气体,则E是Cl2 , 金属H与溶液B反应得到I,I能和氯气反应得到J,而J能与H反应得到I,可知H为变价金属,则H为Fe,溶液B为盐酸,I为FeCl2 , J为FeCl3 , K为Fe(OH)3 , 所以气体B为HCl,则气体D是H2 , 金属A与盐酸反应得到C为盐,C与氨气反应得到的白色沉淀F能溶于氢氧化钠溶液,所以A是Al、C是AlCl3、F是Al(OH)3、G是NaAlO2;(1)上述分析可知,D是H2 , G是NaAlO2 , 故答案为:H2 , NaAlO2;(2)C→F的反应为氯离子在氨水中反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+ , 故意答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;(3)F→G的反应为氢氧化铝溶解于氢氧化钠溶液生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;(4)I→J的反应为氯气氧化亚铁离子诶铁离子,反应的离子方程式:2Fe2++Cl2═2Fe3++2Cl﹣ , 故答案为:2Fe2++Cl2═2Fe3++2Cl﹣;(5)在FeCl2溶液中滴入NaOH溶液,会生成氢氧化亚铁沉淀,在空气中会被迅速氧化为氢氧化铁,则可观察到的现象是产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,化学反应方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3 , 故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;(6)200mL 3mol/L FeCl3 , n(FeCl3)=0.2×3=0.6mol,60g铁、铜混合物(铁和铜的物质的量比为1:1),则n(Fe)=n(Cu)=60/(56+64)=0.5mol,Fe的还原性强于Cu,则先发生:2Fe3++Fe=3Fe2+ , 0.6mol Fe3+完全反应需要0.3mol Fe,小于0.5mol,所以溶液中的溶质为氯化亚铁,氯化亚铁的物质的量为0.6mol×3/2=0.9mol,充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体为氧化铁,根据Fe元素守恒,氧化铁的物质的量为0.9/2=0.45mol,所以氧化铁的质量为0.45×160=72g,故答案为:72g. 黄绿色气体电子E为Cl2 , 金属H与溶液B反应得到I,I能被氯气氧化得到J,而J能与H反应得到I,故金属H为变价金属,可推知H为Fe,B为盐酸,I为FeCl2 , J为FeCl3 , K为Fe(OH)3 , 故B为HCl,气体单质D为H2 , 金属A与盐酸反应得到C为盐,能与氨气反应得到白色沉淀F,且白色沉淀F溶于氢氧化钠溶液得到G,可推知A为Al、C为AlCl3、F为Al(OH)3、G为NaAlO2 , 据此解答.


科目:高中化学 来源: 题型:
【题目】利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是( )

①浓氨水和固体NaOH制NH3 ②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2 ⑥锌粒和稀硫酸制H2
A. ②③ B. ①⑥ C. ②③⑤⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是
(3)D是由两种元素组成的三原子分子,电子式是
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式
(5)E+F→C+D写出该方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 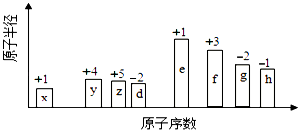
根据判断出的元素回答问题:
(1)f 在元素周期表的位置是;g的离子结构示意图为 .
(2)在z、d、e、f 四种元素中,其离子半径按由大到小的排列顺序为(用 化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性较强的是: .
(3)由x和z元素组成一种四原子共价化合物,写出其电子式 .
(4)由x、z、h三种元素构成的盐,其水溶液显酸性,用离子方程式解释其原因 .
(5)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列关于电解质的说法中正确的是
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多
B. 向NH4Cl溶液中加入少量等浓度的稀盐酸,则![]() 的值减小
的值减小
C. 向NaHS溶液中加入适量 KOH 后:c(Na+)=c(H2S)+c(HS-)+c(S2-)
D. 将a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合(忽略体积、温度变化),所得溶液中c(Na+)=c(CH3COO-),则醋酸的电离常数Ka=![]() (用含a的代数式表示)
(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】字母A﹣F代表六种不同物质,它们之间可发生如图的转化(部分反应中生成物没有全部列出).其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧.分析图示回答下列问题: 
(1)A可以是或;
(2)E在CO2中燃烧的化学方程式为;
(3)D与F反应的化学方程式为 , 该反应中D表现了性;
(4)50mL 14molL﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
A. 密闭容器中氨气的体积分数不变
B. 1mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 2v(NH3)=v(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g ) ![]() C2H4(g)+4H2O(g)。0.1Mpa时,按n(CO2):n(H2)=1:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是( )
C2H4(g)+4H2O(g)。0.1Mpa时,按n(CO2):n(H2)=1:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是( )

A. 该反应的ΔH<0
B. 曲线b代表H2O
C. N点和M点所处的状态c(H2)不一样
D. 其它条件不变,T1℃、0.2MPa下反应达平衡时c(H2)比M点大
【答案】C
【解析】温度升高,H2的浓度增大,平衡左移,故逆向吸热,正向放热,△H<0,则曲线a为CO2,根据方程式的比例关系,可知曲线b为H2O, 曲线c为C2H4;故A正确,B正确;C项:N点和M点均处于所处同一T1℃下,所处的状态的c(H2)是一样的;D项: 其它条件不变,T1℃、0.2 MPa相对0.1 MPa,增大了压强,体积减小,c(H2)增大,下反应达平衡时c(H2)比M点大,D项正确。
【题型】单选题
【结束】
12
【题目】据报导,我国已研制出“可充室温钠-二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠-四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是( )
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是( )
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3mol CO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3—4e-===3CO2↑+4Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com