
分析 Ⅰ、用火烧法除去漆层后,铜表面可生成一层黑色CuO,会影响焊接质量,在酒精中蘸一下,乙醇能还原氧化铜生成Cu,排除了CuO对焊接质量的影响;
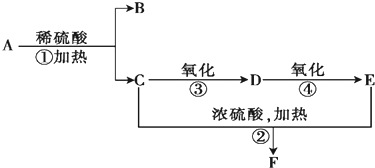
Ⅱ、A是一种酯,它的分子式为C5H10O2,根据转化关系,A在酸性条件下水解生成C和B,C能连续被氧化,则C应为醇,B、C的相对分子质量相等,所以C为CH3CH2CH2OH,B为CH3COOH,C氧化得D为CH3CH2CHO,D氧化得E为CH3CH2COOH,C和E发生酯化反应生成F为CH3CH2COOCH2CH2CH3,据此答题.
解答 解:Ⅰ、用火烧法除去漆层后,铜表面可生成一层黑色CuO,会影响焊接质量,在酒精中蘸一下,乙醇能还原氧化铜生成Cu,反应原理方程式为:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+CH3CH2OH$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CH3CHO+H2O,
故答案为:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+CH3CH2OH$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CH3CHO+H2O;
Ⅱ、A是一种酯,它的分子式为C5H10O2,根据转化关系,A在酸性条件下水解生成C和B,C能连续被氧化,则C应为醇,B、C的相对分子质量相等,所以C为CH3CH2CH2OH,B为CH3COOH,C氧化得D为CH3CH2CHO,D氧化得E为CH3CH2COOH,C和E发生酯化反应生成F为CH3CH2COOCH2CH2CH3,
(1)B为CH3COOH,B的名称是乙酸,D为CH3CH2CHO,
故答案为:乙酸;CH3CH2CHO;
(2)反应②的化学方程式为CH3CH2COOH+CH3CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3CH2COOCH2CH2CH3+H2O,④的化学方程式为2CH3CH2CHO+O2$→_{△}^{Cu}$2CH3CH2COOH,
故答案为:CH3CH2COOH+CH3CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3CH2COOCH2CH2CH3+H2O;2CH3CH2CHO+O2$→_{△}^{Cu}$2CH3CH2COOH.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确判断A结构简式是解本题关键,B、C的相对分子质量相等是推断的突破点,本题难度不大.


科目:高中化学 来源: 题型:解答题
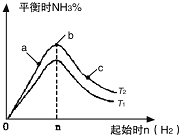 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
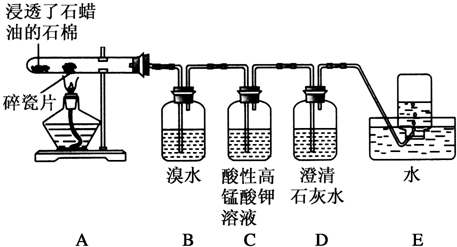
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥③⑥⑤⑥ | B. | ②⑥③⑥⑤⑥ | C. | ①⑥④⑥⑤⑥ | D. | ②⑥④⑥⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的元素与被还原的元素质量比为1:1 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | NaBH4即使氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
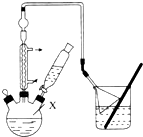 对叔丁基苯酚
对叔丁基苯酚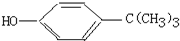 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51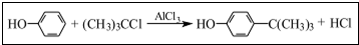 .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体能发生电泳现象 | B. | 胶体能产生丁达尔现象 | ||
| C. | 胶体粒子直径在1~100nm之间 | D. | 胶体在一定条件下能聚沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
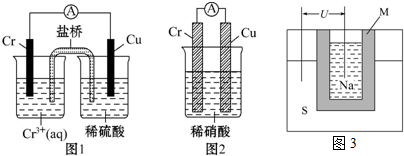
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com