
分析 Cu2S与一定质量的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.令NO2和NO的物质的量分别为1mol、1mol,根据电子转移守恒计算参加反应的Cu2S的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4),由硫元素守恒可知n(Cu2S)=n(CuSO4),据此计算参加反应的硝酸的物质的量.据此计算判断.
解答 解:Cu2S与一定质量的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.
令NO2和NO的物质的量分别为1mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6-(-2)+1×2]=1mol×(5-4)+1mol×(5-2),解得n(Cu2S)=0.4mol,
由硫元素守恒可知n(CuSO4)=n(Cu2S)=0.4mol,
根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4)=2×0.4mol-0.4mol=0.4mol,
由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.4mol+1mol+1mol=2.8mol.
所以实际参加反应的Cu2S与HNO3的物质的量之比为n(Cu2S):n(HNO3)=0.4mol:2.8mol=1:7,
故答案为:1:7.
点评 本题考查氧化还原反应的基本概念与计算,难度中等,判断元素化合价变化,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用.


科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
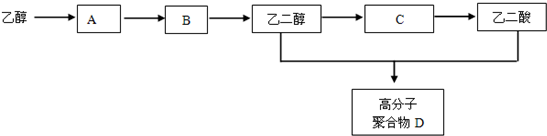

 +(2n-1)H2O 反应类型为聚合反应.
+(2n-1)H2O 反应类型为聚合反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com